Tabelas para impressão
Plano de Aula
Plano de aula: Lei das Proporções Constantes (Lei de Proust)
Plano 3 de uma sequência de 5 planos. Veja todos os planos sobre Aspectos quantitativos das transformações químicas
Tem interesse no tema "Neurociência, adolescências e engajamento nos Anos Finais"?
Inscreva-se neste tema para receber novidades pelo site e por email.
Habilidades BNCC:

Precisa de ajuda para criar uma aula personalizada?
Crie seu plano de aula em menos de um minuto no WhatsApp.
Aula
Sobre este plano

Este slide não deve ser apresentado para os alunos, ele apenas resume o conteúdo da aula para que você, professor, possa se planejar.
Sobre esta aula: Para o pleno desenvolvimento desse plano, é essencial que os alunos tenham construído e desenvolvido habilidades
referente ao 2º plano desta unidade, sobre Lei da Conservação das Massas e análise de dados tabelados de reações químicas.
Este plano tem como objetivo possibilitar que os alunos analisem e identifiquem a Lei das Proporções Constantes (Lei de Proust) em reações químicas, através da análise de dados tabelados e a partir de um desafio que irá inserir os alunos em um contexto investigativo.
O professor deverá contar uma história, na qual os alunos (divididos em equipes) estarão concorrendo a uma vaga no maior laboratório nacional em produção de gás carbônico. Nesse contexto, o professor, que interpretará o supervisor do laboratório, realizará alguns testes e questões eliminatórias para cada equipe (sorteio de dados tabelados).
Para estudar mais sobre o tema, o professor pode acessar a seguinte referência:
FOGAÇA, Jennifer Rocha Vargas. "Lei de Proust ou Lei das Proporções Constantes"; Brasil Escola. Disponível em <https://brasilescola.uol.com.br/quimica/lei-proust-ou-lei-das-proporcoes-constantes.htm>. Acesso em 30 de agosto de 2018.
Materiais necessários para a aula: Balões (bexigas de aniversário), garrafinha plástica de 250 mL ou 125 mL, colher (ou espátula), vinagre e bicarbonato de sódio. Além disso, também serão necessários materiais para impressão nesta aula, disponíveis nos link abaixo:
Sorteio de tabelas:
Atividade para impressão:
Gabarito da atividade para impressão: < https://nova-escola-producao.s3.amazonaws.com/fZtDvvmq7mkhhxM9E6uPEngDxzEvZAbRDeWChnZNTn2Sckd9khKS633u8knP/cie9-02me03--gabarito-da-atividade.pdf>.
Título da aula

Tempo sugerido: 2 minutos
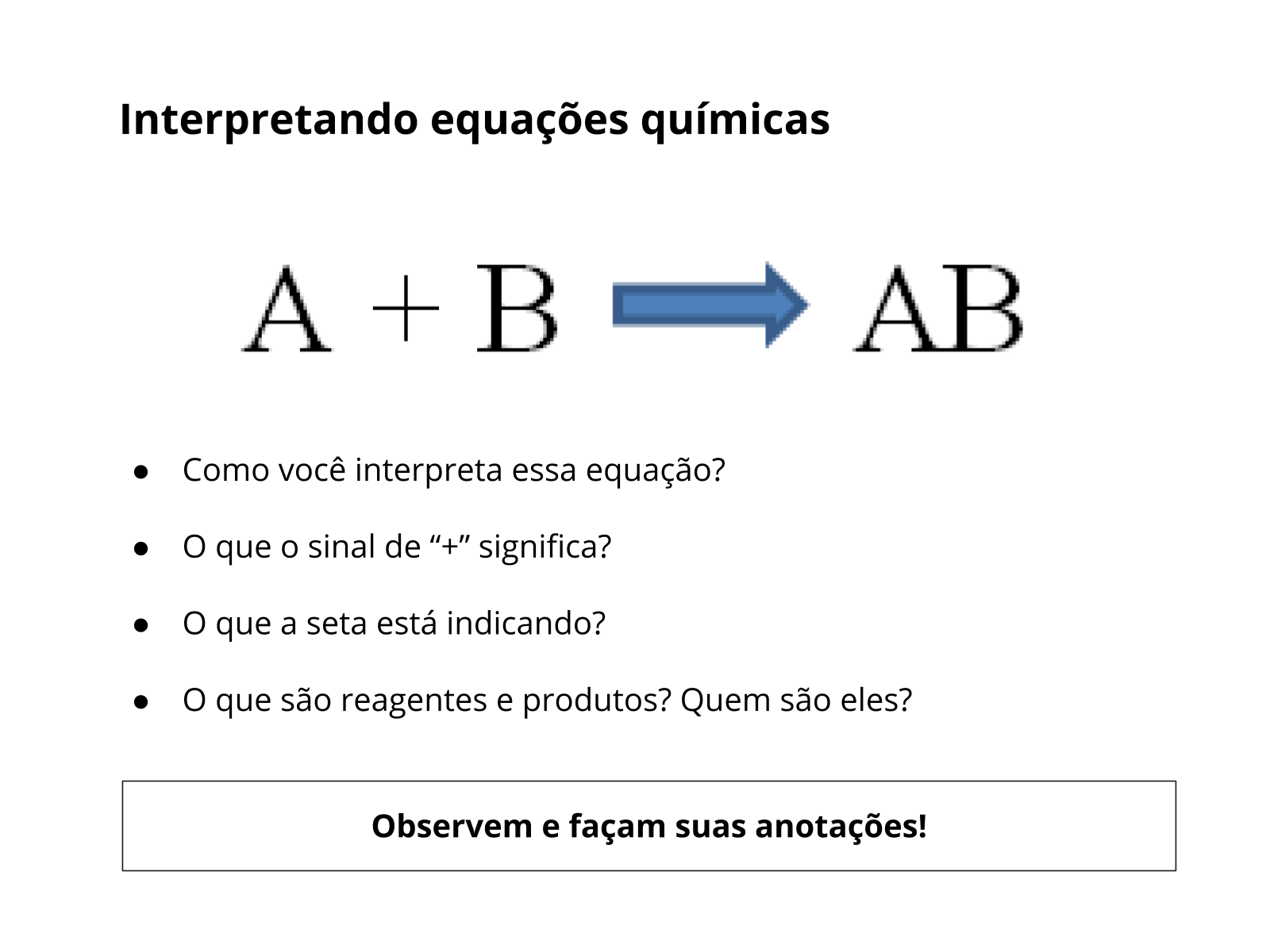
Orientações: Leia o título da aula para os alunos e faça as seguintes perguntas:
- O que vocês entendem pela leitura do título?
- O que é uma lei científica?
- O que significa proporção?
- O que significa dizer que algo é constante?
Instigue os alunos a desenvolverem suas hipóteses e argumentos com relação ao título da aula, com o objetivo de analisar seus conhecimentos prévios.
Os alunos devem lembrar da aula anterior (Lei da Conservação das Massas): uma lei é caracterizada como a observação de um fenômeno que ocorre com determinado padrão e regularidade, ou seja, uma lei implica que algo ocorrerá da forma prevista por ela, não podendo ser refutada.
Com relação a palavra “proporção”, os alunos devem concluir que ela diz respeito a uma relação de grandeza entre diversas partes. O professor pode dar o seguinte exemplo:
- Para fazer um bolo são necessários 3 ovos, 3 xícaras de farinha, 2 xícaras de açúcar, etc. Para fazer o dois bolos, é preciso aumentar as quantidades de ingredientes na mesma proporção (dobrando), ou seja, são usados 6 ovos, 6 xícaras de farinha e 4 xícaras de açúcar.
Ou seja, proporção está diretamente ligada à relação entre as quantidades, como no caso do bolo, em receitas em geral, e na Química em particular. A palavra proporção também pode estar relacionada com a relação entre as dimensões, por exemplo, em uma escultura, mas não é este o sentido atribuído à palavra quando estudamos transformações químicas e os aspectos quantitativos das mesmas.
Sobre a palavra “constante”, os alunos devem chegar à conclusão de que é algo que permanece invariável e fixo. O professor pode dar o exemplo:
- Aquele carro está viajando a uma velocidade constante de 10 m/s.
Novo curso gratuito

Conheça nosso mais novo curso sobre adolescências, neurociência e engajamento nos anos finais
VER CURSO