Atividade para impressão 1 - Propriedades dos compostos
Plano de Aula
Plano de aula: Propriedades dos compostos
Plano 4 de uma sequência de 5 planos. Veja todos os planos sobre Mudanças de estado físico da matéria
Por: Ellen Bernardi
Tem interesse no tema "Neurociência, adolescências e engajamento nos Anos Finais"?
Inscreva-se neste tema para receber novidades pelo site e por email.
Habilidades BNCC:

Precisa de ajuda para criar uma aula personalizada?
Crie seu plano de aula em menos de um minuto no WhatsApp.
Aula
Sobre este plano

Este slide não deve ser apresentado para os alunos, ele apenas resume o conteúdo da aula para que você, professor, possa se planejar.
Sobre esta aula: Nesta aula, você encontrará orientações e direcionamentos de atividade para trabalhar com os alunos uma das habilidades de Ciências contempladas nas diretrizes da Base Nacional Comum Curricular. A habilidade não será contemplada em sua totalidade, sua propostas podem ter continuidade em aulas subsequentes. Este é considerado o quarto plano de aula de uma sequência de aulas relacionadas às mudanças de estado físico e sua relação com constituição submicroscópica da matéria. Assim, para saber mais sobre as temáticas desenvolvidas, você poderá consultar as aulas CIE9_01ME01, CIE9_01ME02 e CIE9_01ME03.
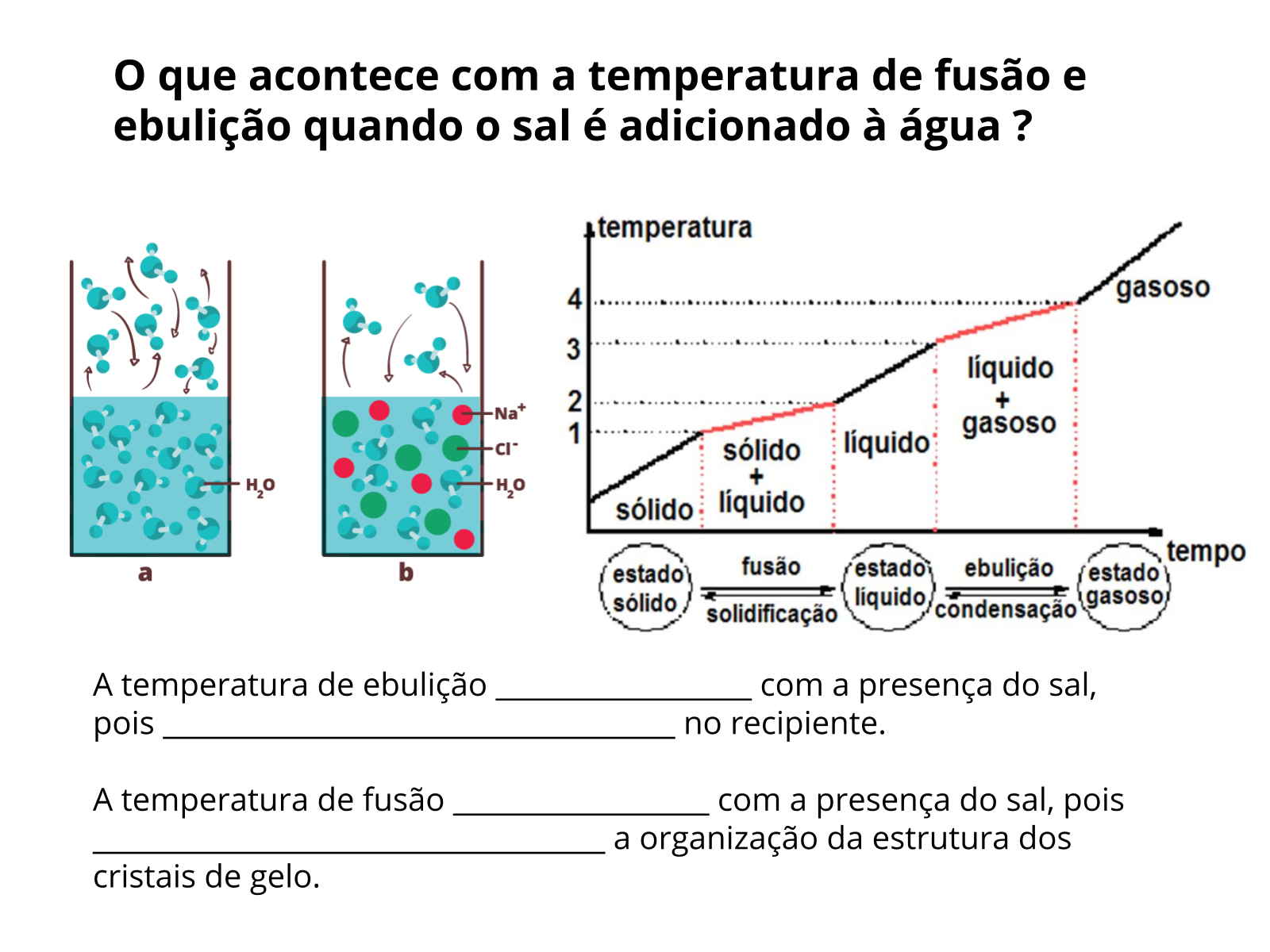
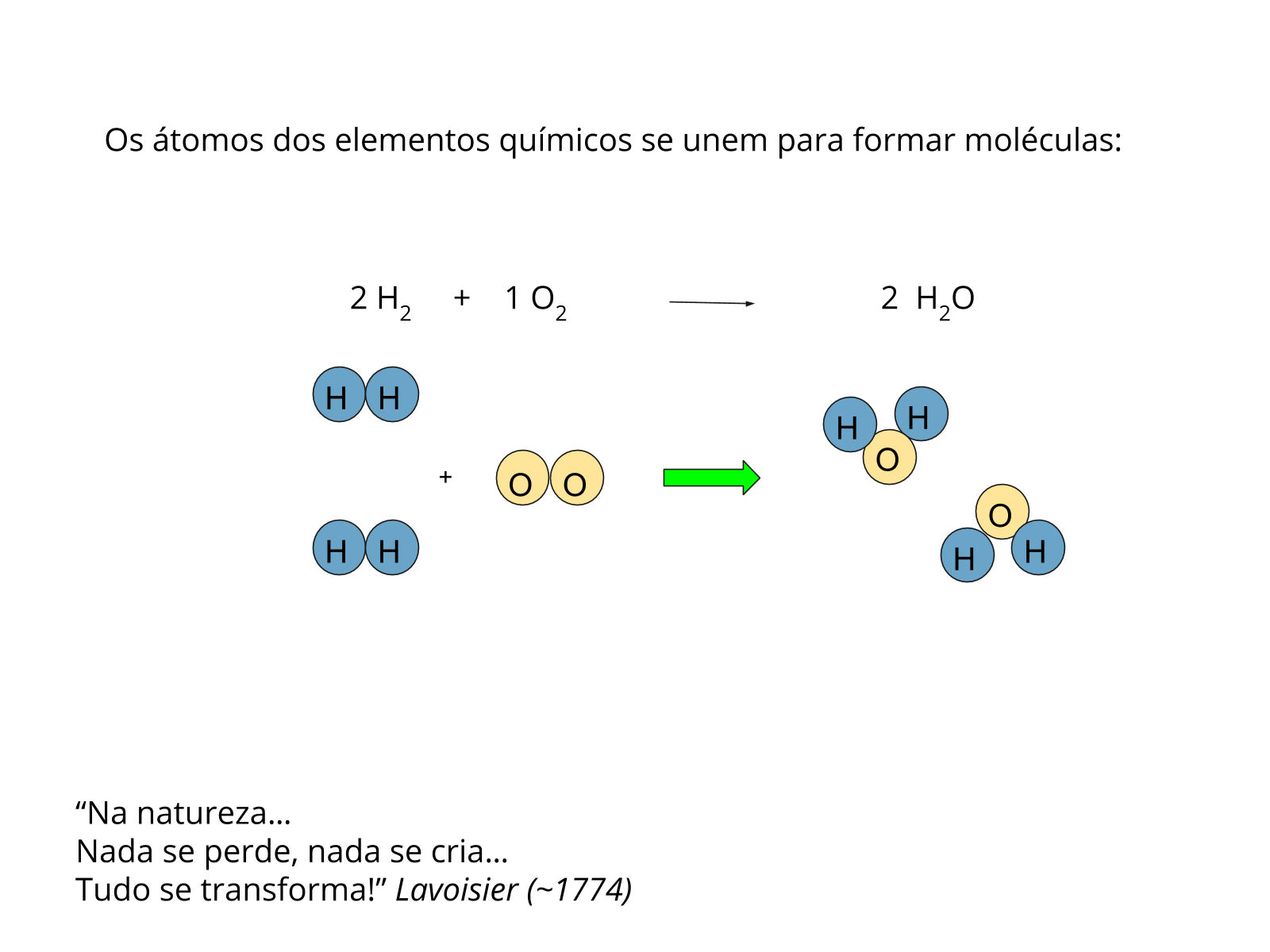
Nessa aula, a temática envolve propriedades específicas dos compostos, como o ponto de fusão e de ebulição, propriedades dependentes das interações entre as partículas constituintes, ou seja, elas podem ser interpretadas a nível submicroscópico em função de diferentes maneiras com que as partículas estão organizadas.
Os compostos iônicos são constituídos por íons carregados e a interação entre eles se dá através da atração eletrostática, sendo essa força que os mantém unidos muito forte. Por sua vez, os compostos moleculares são constituídos por moléculas, e as interações entre elas, as interações intermoleculares, é mais fraca. Essa interação mais fraca entre as moléculas faz com que a energia necessária para separá-las e fazê-las mudar de estado de agregação seja menor do que nos compostos iônicos.
Caso necessário, sugiro a leitura das páginas 74 a 92 do livro: CISCATO, C. A. M.; PEREIRA, L. F. Planeta Química. Editora Ática S.A. São Paulo, 1a edição, 2008, e página 8 da apostila sobre Determinações de ponto de fusão e ebulição, disponível em <http://www.ufjf.br/quimica/files/2014/08/Apostila-Laboratorio-QO1-vers%C3%A3o-1.3-2016.pdf> (acesso em 02/09/2018) .
Caso deseje uma leitura complementar para se aprofundar no tema, sugiro: REY, N. A. Ligações químicas: covalentes e iônicas, disponível em: <http://web.ccead.puc-rio.br/condigital/mvsl/Sala%20de%20Leitura/conteudos/SL_ligacoes_quimicas.pdf> (acesso em 02/09/2018).
Materiais necessários para a aula: Projetor multimídia e/ou quadro negro, folhas sulfite, canetas coloridas e o material impresso:
Tabela com dados de temperatura de ebulição e fusão.
Atividade de indentificação.
Texto contendo a conceitualização do tema.
Título da aula

Tempo sugerido: 2 minutos
Orientações: Projete ou leia o tema da aula e comente com os alunos que nessa aula eles irão analisar dados a partir dos quais levantarão hipóteses sobre as diferenças entre as temperaturas de fusão e ebulição dos compostos, relacionando-as com a visão submicroscópica da matéria. Se você estiver seguindo a ordem dos planos desta unidade, aproveite para recordar os temas já trabalhados, como forma de conectar a temática desta presente aula:
- “O que acontece nos ponto de fusão e ponto de ebulição das substâncias?”
- “Como os compostos iônicos e moleculares se diferenciam?”
Novo curso gratuito

Conheça nosso mais novo curso sobre adolescências, neurociência e engajamento nos anos finais
VER CURSO