Atividade para impressão - Mão na Massa - Compostos moleculares e iônicos
Plano de Aula
Plano de aula: Compostos moleculares e iônicos
Plano 3 de uma sequência de 5 planos. Veja todos os planos sobre Mudanças de estado físico da matéria
Por: Ellen Bernardi
Tem interesse no tema "Neurociência, adolescências e engajamento nos Anos Finais"?
Inscreva-se neste tema para receber novidades pelo site e por email.
Habilidades BNCC:

Precisa de ajuda para criar uma aula personalizada?
Crie seu plano de aula em menos de um minuto no WhatsApp.
Aula
Sobre este plano

Este slide não deve ser apresentado para os alunos, ele apenas resume o conteúdo da aula para que você, professor, possa se planejar.
Sobre esta aula: Este plano é parte de uma sequência de aulas que, quando associadas, conseguem trabalhar de forma mais completa e integrada a temática. Esta é a terceira aula de uma sequência de 5 aulas que contempla a Habilidade EF09CI01. Portanto, este plano será melhor aproveitado se depois dele for realizado o plano CIE9_01ME04.
Nesta aula serão abordados aspectos submicroscópicos da matéria, onde os compostos moleculares e iônicos, suas propriedades e diferenciações serão nosso tema central.
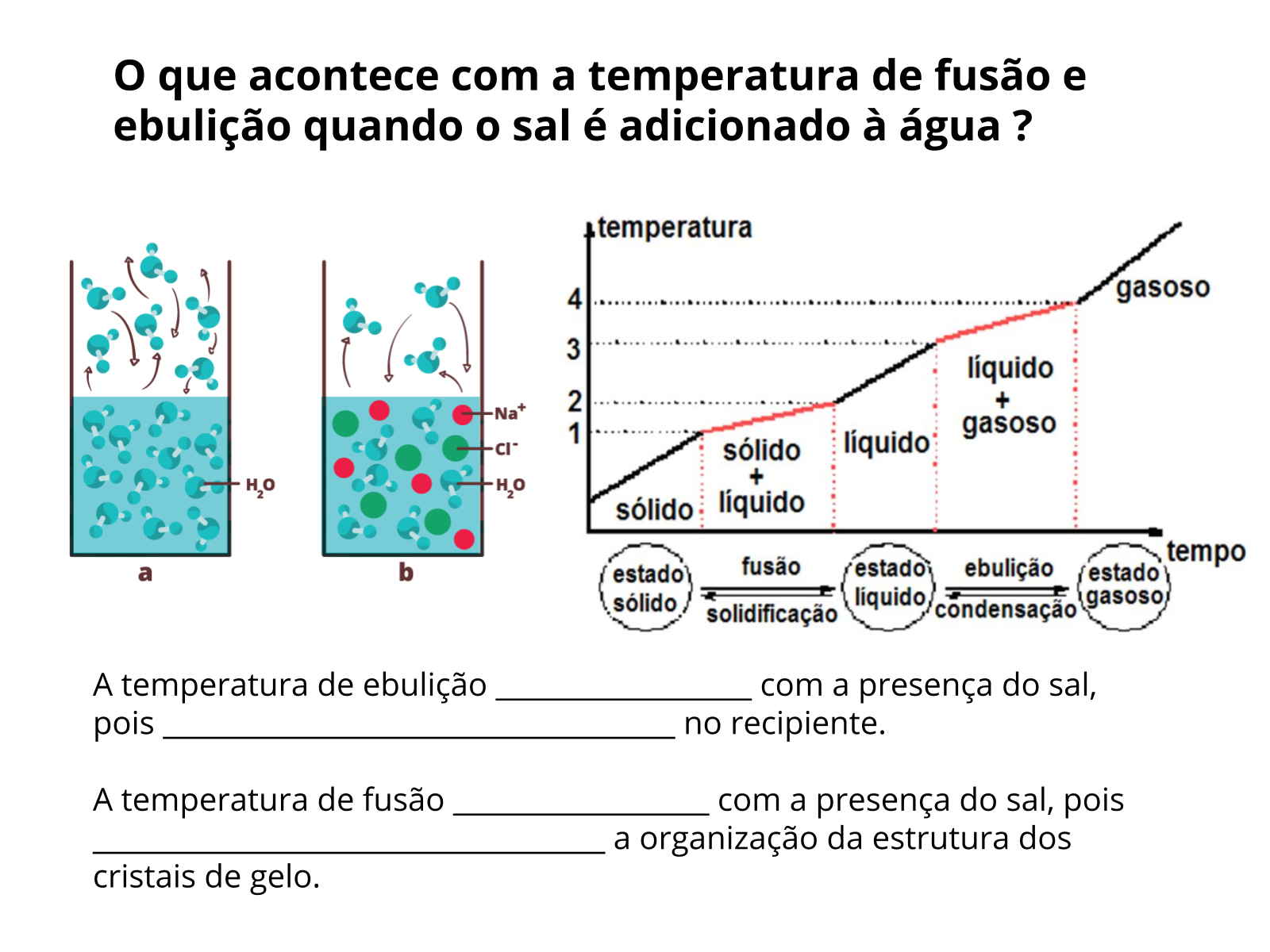
Classificamos os compostos em iônicos e moleculares. Os compostos iônicos são aqueles que possuem uma ou mais ligações iônicas, mesmo que apresente várias ligações covalentes, ou seja, são formados por cátions e ânions. Na ligação iônica, as forças de atração são conseqüência da transferência completa de um ou mais elétrons de um átomo para outro sendo que um deles adquire carga positiva e o outro, negativa, surgindo as forças responsáveis pela ligação. A maioria dos compostos iônicos são sólidos, nas temperatura e pressão ambientes, porque a força de atração elétrica que mantém os cátions e os ânions firmemente ligados uns aos outros é muito forte.
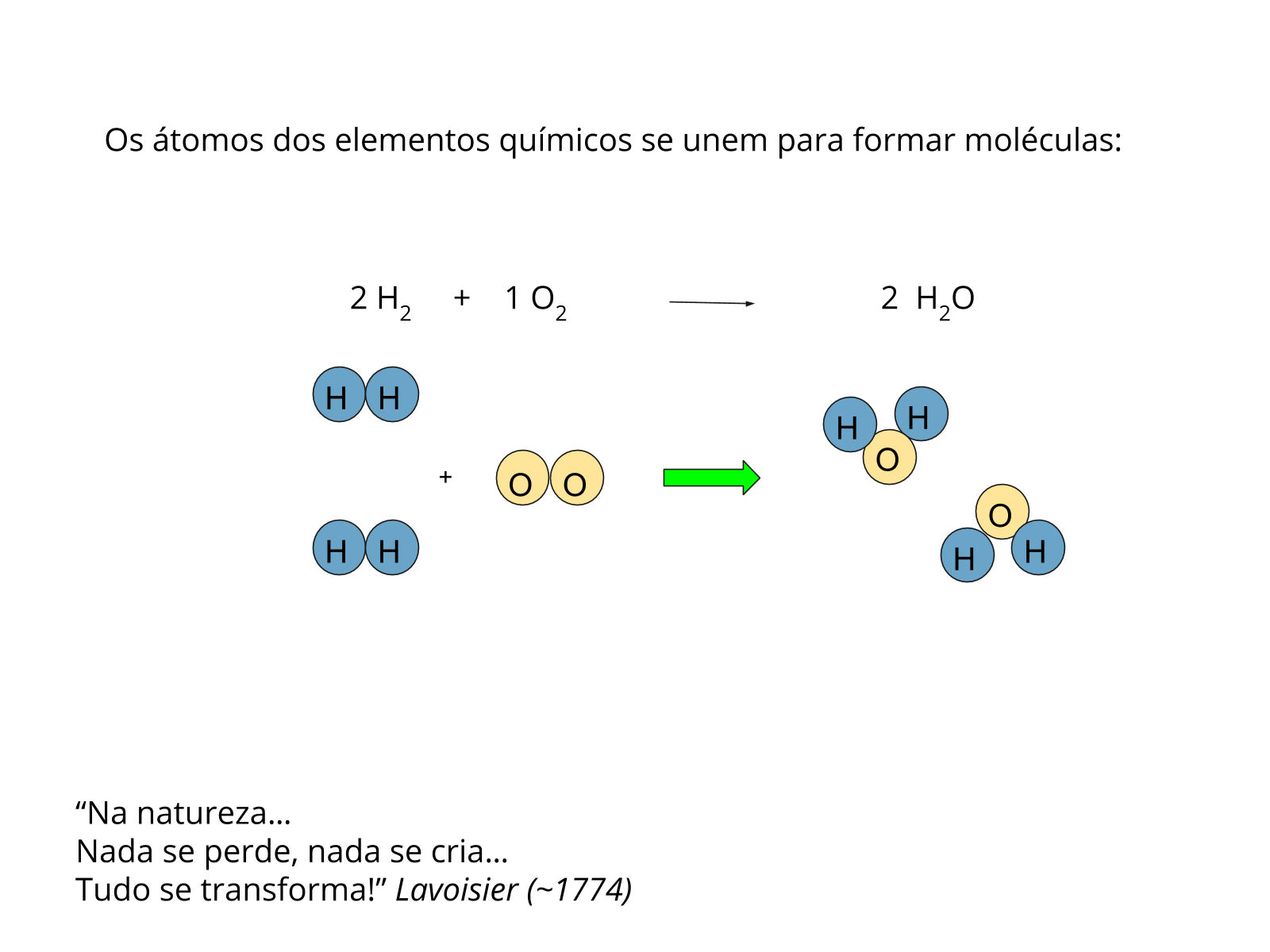
Os compostos moleculares são aqueles que possuem somente ligações covalentes entre seus átomos. A menor partícula deste composto denomina-se molécula. Na ligação covalente a transferência de elétrons nunca é completa, pois estes são compartilhados e neste caso a força de atração entre o par de elétrons (carga negativa) e o núcleo (carga positiva) é o que mantêm os átomos unidos, sendo muito mais fraca que a força eletrostática dos compostos iônicos. Por isso, geralmente, as temperaturas de fusão e ebulição dos compostos moleculares são muito menores que dos iônicos de massa molecular semelhante.
Uma característica marcante dos compostos iônicos é que quando dissolvidos em água a condução de corrente elétrica se torna possível. Água pura não é condutora, compostos iônicos no estado sólido também não. Isto porque para haja condução de corrente elétrica é preciso haver cargas em movimento (os elétrons livres nos metais, e íons nas soluções). Portanto, quando uma substância se dissolve em água e a condução de corrente elétrica passa a acontecer, são grandes as chances dessa substância ser um composto iônico, como sal de cozinha (NaCl), por exemplo. Alguns compostos moleculares, como HCl (ácido clorídrico) também se dissolvem em água gerando íons, mas isto não é verdade para todos os compostos moleculares. Açúcar, por exemplo, se dissolve em água, mas não produz íons e, portanto, uma solução de água com açúcar não irá conduzir corrente elétrica.
Algumas referências que podem ajudá-lo a se aprofundar neste tema:
FOGAÇA, J.R.V. Características e propriedades dos compostos iônicos, Mundo Educação. Disponível em <https://mundoeducacao.bol.uol.com.br/quimica/caracteristicas-propriedades-dos-compostos-ionicos.htm>, acesso em 12 de agosto de 2018.
FOGAÇA, J.R.V. Características e propriedades dos compostos covalentes, Mundo Educação. Disponível em: <https://mundoeducacao.bol.uol.com.br/quimica/caracteristicas-propriedades-dos-compostos-covalentes.htm>, acesso em 12 de agosto de 2018.
MARGOTO, M. Acendeu ou não acendeu?, em XI Mostra de Trabalhos “ABC na Educação Científica - Mão na Massa, CDCC/USP, 2014, pág. 31-40. Disponível em: <http://www.cdcc.usp.br/maomassa/mostras/2014/Anais_XI_Mostra_2014.pdf>, acesso 12 de agosto de 2018.
BOFF, E. T.O & FRISON, M.D. Explorando a existência de cargas elétricas na matéria, Química Nova na Escola, n. 3, 11-14, 1996. Disponível em: <http://qnesc.sbq.org.br/online/qnesc03/relatos.pdf>, acesso em 12 de agosto de 2018.
Materiais necessários para a aula: Tomada (ou pilhas), fio elétrico tipo simples (aproximadamente 40 cm para cada grupo), lâmpada comum ou de led (1 para cada grupo), alicate de corte, fita isolante, pregos (2 para cada grupo), água pura (destilada - pode ser encontrada em farmácias, drogarias e lojas de equipamentos automobilísticos), sal de cozinha, açúcar, recipientes (copos plásticos podem ser utilizados). Materiais complementares: tabela para desenvolvimento do mão na massa e orientações para montar o aparelho de medir condutividade.
Materiais necessários: Condutivímetro montado previamente, água pura (destilada - pode ser encontrada em farmácias, drogarias e lojas de equipamentos automobilísticos), sal de cozinha, hipoclorito de sódio, açúcar, recipientes (copos plásticos podem ser utilizados).
Tabela para impressão e desenvolvimento da atividade nos materiais complementares
Construção do condutivímetro: o testador de condutividade deverá ser montado antes pelo professor. A montagem é simples, mas não dará tempo de montar durante a aula. Uma possibilidade é que a montagem seja feita pelos alunos uma aula antes desta. Esta proposta será mais engajadora, pois eles irão utilizar um equipamento construído por eles. O site Ponto Ciência traz um roteiro simples e detalhado de como fazer a montagem. Se você resolver que os alunos irão fazer a construção, imprima o roteiro ou projeto para a clase na aula reservada para a montagem do equipamento. O roteiro se encontra disponível aqui: <http://pontociencia.org.br/experimentos/visualizar/testador-de-condutividade/203>, acesso em 12 de agosto de 2018.
Título da aula

Tempo sugerido: 2 minutos
Orientações: Leia o tema da aula e comente com os alunos que eles irão discutir sobre as propriedades dos compostos, e que algumas delas podem ser usadas para diferenciar compostos moleculares dos iônicos, como sal e açúcar, ambos sólidos brancos.
Novo curso gratuito

Conheça nosso mais novo curso sobre adolescências, neurociência e engajamento nos anos finais
VER CURSO