Atividade para impressão - Mão na massa - Propriedades das substâncias e das misturas
Plano de Aula
Plano de aula: Propriedades das substâncias e das misturas
Plano 2 de uma sequência de 5 planos. Veja todos os planos sobre Mudanças de estado físico da matéria
Por: Ellen Bernardi
Tem interesse no tema "Neurociência, adolescências e engajamento nos Anos Finais"?
Inscreva-se neste tema para receber novidades pelo site e por email.
Habilidades BNCC:

Precisa de ajuda para criar uma aula personalizada?
Crie seu plano de aula em menos de um minuto no WhatsApp.
Aula
Sobre este plano

Este slide não deve ser apresentado para os alunos, ele apenas resume o conteúdo da aula para que você, professor, possa se planejar.
Sobre esta aula: Este plano é parte de uma sequência de aulas que, quando associadas, conseguem trabalhar de forma mais eficiente a temática. Nesta aula os alunos irão trabalhar com gráficos de mudança de estado físico de uma substância pura, a água, e de uma mistura, água e sal de cozinha.
A habilidade de ciências não será trabalhada em sua totalidade neste plano, sendo assim, as propostas podem ter continuidade nas próximas aulas.
Sugerimos que a aula CIE9_01ME01 já tenha sido realizada, pois assim os alunos já terão sido introduzidos à natureza submicroscópica da matéria. Esta unidade tem como objetivo maior levar os alunos a compreender que a matéria é constituída de partículas submicroscópicas, átomos e moléculas, e que suas propriedades são funções de sua estrutura e de como essas partículas interagem. A unidade CIE9_03ME irá tratar especialmente dos modelos atômicos, portanto, aqui basta que os alunos compreendam a natureza particular da matéria e se familiarizem com os termos átomos e moléculas.
Sugestões de leitura para este plano:
BRADY, E.; SENESE, F. Química, a matéria e suas transformações, volume 1. Rio de Janeiro, editora LTC, 2012, 5a edição.
DIAS, D. L., Forças intermoleculares e o ponto de ebulição das substâncias, Brasil Escola. Disponível em: <https://brasilescola.uol.com.br/quimica/forcas-intermoleculares-ponto-ebulicao-das-substancias.htm>, acesso em 07 de agosto de 2018.
Se você sentir necessidade de aprofundar mais sobre a natureza submicroscópica da natureza e as dificuldade de aprendizagem dos alunos em relação a este tema, veja a dissertação de mestrado de Mayara Soares de Melo, “A transição entre os níveis - Macroscópio, submicroscópico e representacional - uma proposta metodológica”, disponível em: <http://repositorio.unb.br/bitstream/10482/19177/1/2015_MayaraSoaresdeMelo.pdf>, acesso em 07 de agosto de 2018. A introdução traz um boa revisão sobre o assunto.
Materiais necessários para a aula: atividade proposta impressa,, folhas de papel sulfite ou similar, régua, lápis e borracha.
Título da aula

Tempo sugerido: 2 minutos.
Orientações: Leia o tema da aula e pergunte aos alunos o que eles entendem por propriedades das substâncias e como eles diferenciam substâncias de misturas. Observe as respostas dadas, anote-as no quadro e volte a elas no final da aula, mas não as responda ainda.
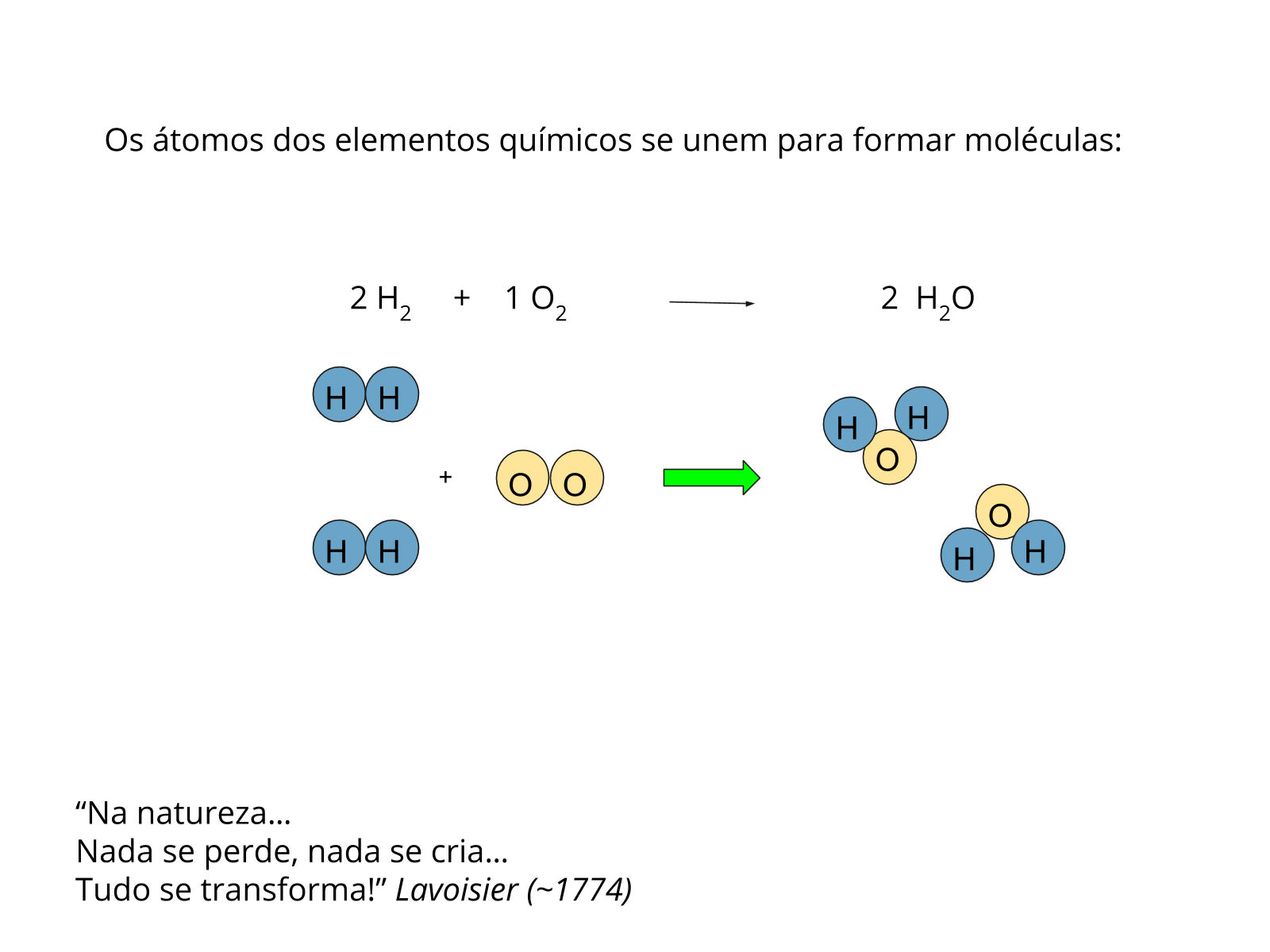
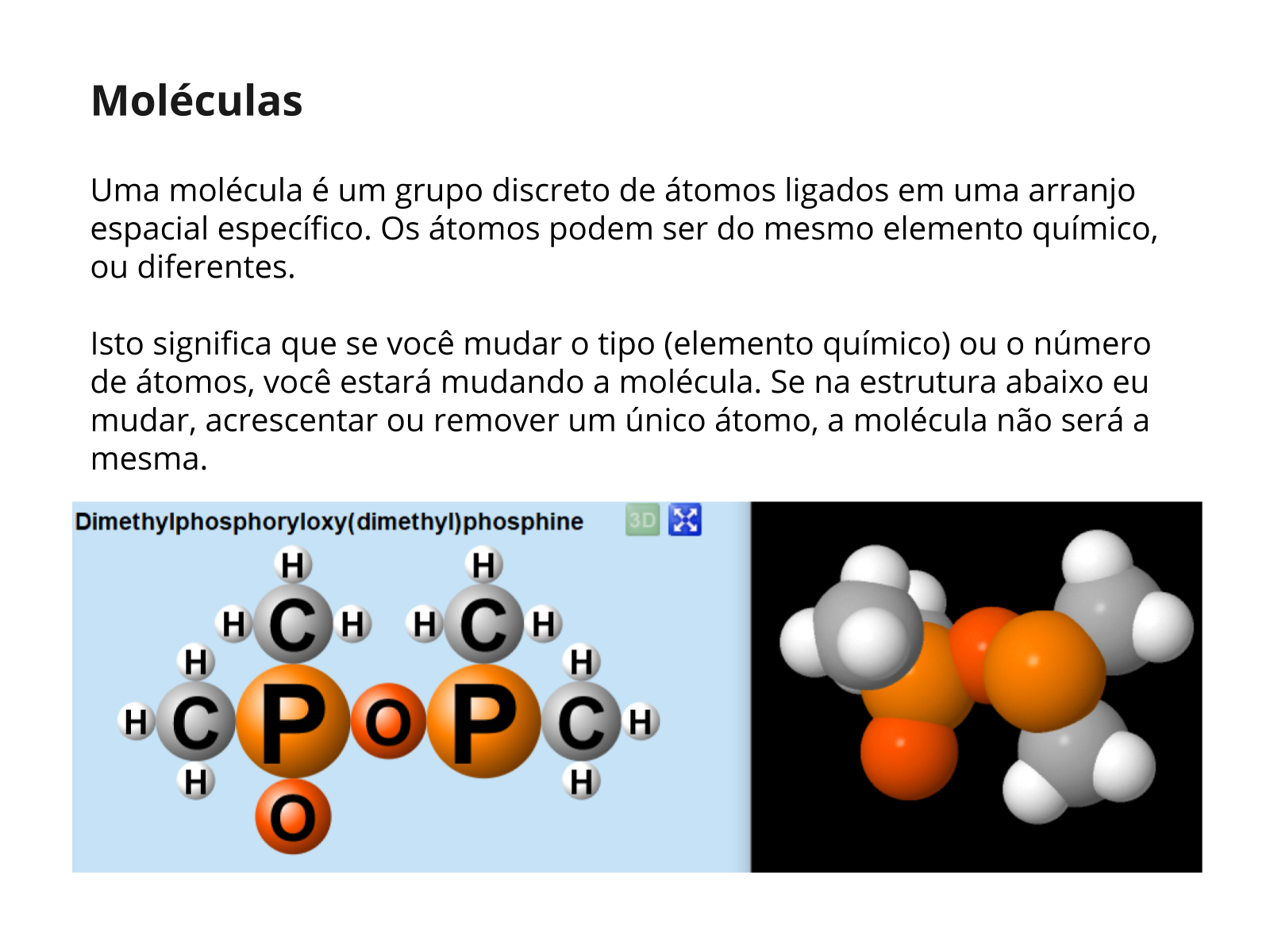
De acordo com Rocha-Filho et al podemos definir substância como a porção de matéria que possui apenas um tipo de constituinte, o qual, por sua vez, foi definido por eles com a unidade que dá identidade a uma substância. Por exemplo, a substância água tem como único constituinte a molécula de água (H2O). A água do mar é, por sua vez, uma mistura, pois é formada de diferentes substâncias dissolvidas na água.
ROCHA-FILHO, R. C.; TOLENTINO, M.; SILVA, R. R.; TUNES, E.; SOUSA, E. C. P. D. Ensino de conceitos em Química. III. Sobre de conceitos de substância. Química Nova, v. 11, n. 4, p. 417-419, 1988, disponível em <http://quimicanova.sbq.org.br/imagebank/pdf/Vol11No4_417_v11_n4_%2811%29.pdf>, acesso 07 de agosto de 2018)
Novo curso gratuito

Conheça nosso mais novo curso sobre adolescências, neurociência e engajamento nos anos finais
VER CURSO