Atividade para Impressão - Construindo modelos
Plano de Aula
Plano de aula: Balanceamento de Equações Químicas
Plano 4 de uma sequência de 5 planos. Veja todos os planos sobre Aspectos quantitativos das transformações químicas
Sobre esta aula

Este slide não deve ser apresentado para os alunos, ele apenas resume o conteúdo da aula para que você, professor, possa se planejar.
referente aos três planos, anteriores, desta unidade, sobre reações de combustão, lei da conservação das massas (Lavoisier) e lei das proporções constantes (Proust).
Este plano tem por objetivo possibilitar que os alunos observem e resolvam o balanceamento de equações químicas através da utilização de modelos de bolas de isopor (representando moléculas) e da análise de dados. Para isso, eles receberão duas atividades que serão desenvolvidas no mão na massa. As atividades a serem impressas estão disponíveis nos links a seguir:
Atividade para impressão 1 - <https://nova-escola-producao.s3.amazonaws.com/W2Ur5MxSuPs8ZZcxPSQKxcaKVYuKVvY2R5qQzSVauvekrAcTN3pE5hYwkee9/atividade-para-impressao-construindo-modelos-cie9-02me04.pdf>.
Atividade para impressão 2 - <https://nova-escola-producao.s3.amazonaws.com/ZPVcn82TjqEuPnGzrQbahNE4d69HvnQCmjU3JWnPaSn5SyahTy47Awqx7DX5/atividade-para-impressao-equacoes-cie9-02me04.pdf>.
O gabarito das atividades podem, também, ser acessados nos links a seguir:
Gabarito da atividade 1 - <https://nova-escola-producao.s3.amazonaws.com/kxzuS8gwMyzZSwBG293bQsK2G7SHmpvj4gzxQvajATqCjud9CQbv2HPsYM3y/resolucao-da-atividade-construindo-modelos-cie9-02me04.pdf>.
Gabarito da atividade 2 - <https://nova-escola-producao.s3.amazonaws.com/VGUd2nGnNGq6bmgxVGcqeNanRhDSJu2AErdbGr8aGp945Y9BAKM52CS8qEA9/resolucao-da-atividade-equacoes-cie9-02me04.pdf>.
O professor deverá providenciar os modelos de bolas das moléculas dos reagentes de acordo com as instruções disponíveis neste link: <https://nova-escola-producao.s3.amazonaws.com/TumB3UNnSqVsUEz5ttyneETYy5qvvWT7bqwN7krD4JREZMa56cP7uazrfXRa/instrucoes-para-o-professor-mao-na-massa-cie9-02me04.pdf>.
Além disso, se houver possibilidade de usar computadores, o professor pode apresentar um jogo simulando o balanceamento de equações químicas. O jogo apresenta três níveis de dificuldade, modelos de moléculas em 3D e também diversas equações para balanceamento. O simulador pode ser acessado através do link <https://phet.colorado.edu/pt_BR/simulation/balancing-chemical-equations>. Acesse o link, inicie com a Introdução e escolha em ferramentas a balança, que facilita a visualização do balanceamento das equações. Depois você pode propor um desafio escolhendo Jogo. O simulador é autoexplicativo e muito simples de usar.
Materiais necessários para a aula: 12 bolas de isopor de 15 mm (por grupo), 1 bola de isopor de 25 mm (por grupo), 6 bolas de isopor de 35 mm (por grupo) 8 bolas de isopor de 50 mm (por grupo), palitos de churrasco, fita adesiva ou cola quente, tinta nas cores vermelho, azul, laranja e verde pincel.
Título da aula

Tempo sugerido: 2 minutos
Orientações: Leia o título da aula para os alunos e faça as seguintes perguntas:
- O que são equações químicas?
- O que é “balanceamento”?
Instigue os alunos a desenvolverem suas hipóteses e argumentos com relação ao título da aula, com o objetivo de analisar seus conhecimentos prévios.
Complemente comentando que equações químicas caracterizam-se como uma representação gráfica de reações químicas, ou seja, equação e reação não são a mesma coisa. A equação química representa, de forma simbólica, a reação entre reagentes para formar os produtos. É uma maneira simples de traduzir o que ocorre, ao invés de escrever um longo texto.
A equação química não diz, por exemplo, qual o procedimento experimental: não descreve vidrarias necessárias, ordem em que os reagentes são adicionados, tempo de reação, massa ou volume de reagente utilizados, processos de purificação etc. Muitas vezes ela diz que é preciso aquecer, por exemplo, trazendo um triângulo sob a seta, mas não necessariamente a temperatura em que a reação acontece ou por quanto tempo é preciso aquecer.
Sobre a palavra balanceamento, o professor pode relacionar as aulas anteriores onde eles viram que a massa se conversa num sistema fechado. Pode fazer uma relação com a frase: nada se cria, nada se perde, tudo se transforma. Ou seja, os elementos que entram como reagentes devem estar todos nos produtos. Talvez uma analogia razoável seja a da balança de 2 pratos, onde reagentes e produtos devem equilibrar a balança.
CONTEXTO

Tempo sugerido: 5 minutos
Orientações: Projete o slide ou desenhe no quadro a equação química que representa a combustão do hidrogênio, assim como, a equação em modelos esféricos para efeito comparativo.
Peça para os alunos formarem pequenos grupos, fazendo as seguintes perguntas para iniciar o desenvolvimento desta etapa:
- Que elementos químicos estão sendo representados nessa equação? O que está acontecendo?
Os alunos devem utilizar os conhecimentos e habilidades construídos no primeiro plano dessa unidade (reações de combustão) para desenvolver seus argumentos, onde, devem concluir que a equação representa a reação de combustão do hidrogênio, para dessa forma, produzir água.
Após os grupos desenvolverem seus argumentos, siga as seguintes instruções para prosseguir:
- As instruções podem ser seguidas por meio do link - <https://nova-escola-producao.s3.amazonaws.com/TumB3UNnSqVsUEz5ttyneETYy5qvvWT7bqwN7krD4JREZMa56cP7uazrfXRa/instrucoes-para-o-professor-mao-na-massa-cie9-02me04.pdf>
- Previamente (antes da realização desse plano), pinte pequenas bolinhas de isopor na cor laranja (representando o hidrogênio) e em azul (representando o oxigênio).
- Monte as moléculas utilizando palitos de dente ou fita adesiva.
- Forneça para cada grupo, apenas uma molécula de hidrogênio (H2) e de oxigênio (O2), conforme a ilustração do slide
- Os grupos devem rearranjar os átomos das moléculas para montar a molécula de água, conforme a ilustração do slide.
- Após todos os grupos montarem a molécula de água, pergunte o que aconteceu no final.
Os grupos devem observar, que após montarem a molécula de água, sobrará apenas uma bolinha representando o átomo de oxigênio (equação não balanceada).
QUESTÃO DISPARADORA

Tempo sugerido: 2 minutos
Orientações: Leia a questão disparadora para a turma, fazendo as seguintes perguntas:
- Podemos afirmar que a equação está correta?
- Por que o átomo restante, de oxigênio, não aparece na equação?
- O que deve ser feito com esse átomo?
Permita que os grupos façam suas observações e criem hipóteses a respeito desses questionamentos, a partir da análise da equação de combustão do hidrogênio. Pode-se desenhar no quadro ou retornar ao slide anterior.
MÃO NA MASSA
Tempo sugerido: 30 minutos
Orientações: Projete o slide ou imprima uma cópia para cada grupo. Permita que os grupos iniciem um debate, a fim de desenvolverem seus argumentos e conclusões a partir da análise das perguntas (é sugerida uma estimativa de 5 minutos para a realização dessa atividade).
Nesta etapa, os alunos devem chegar até as seguintes conclusões:
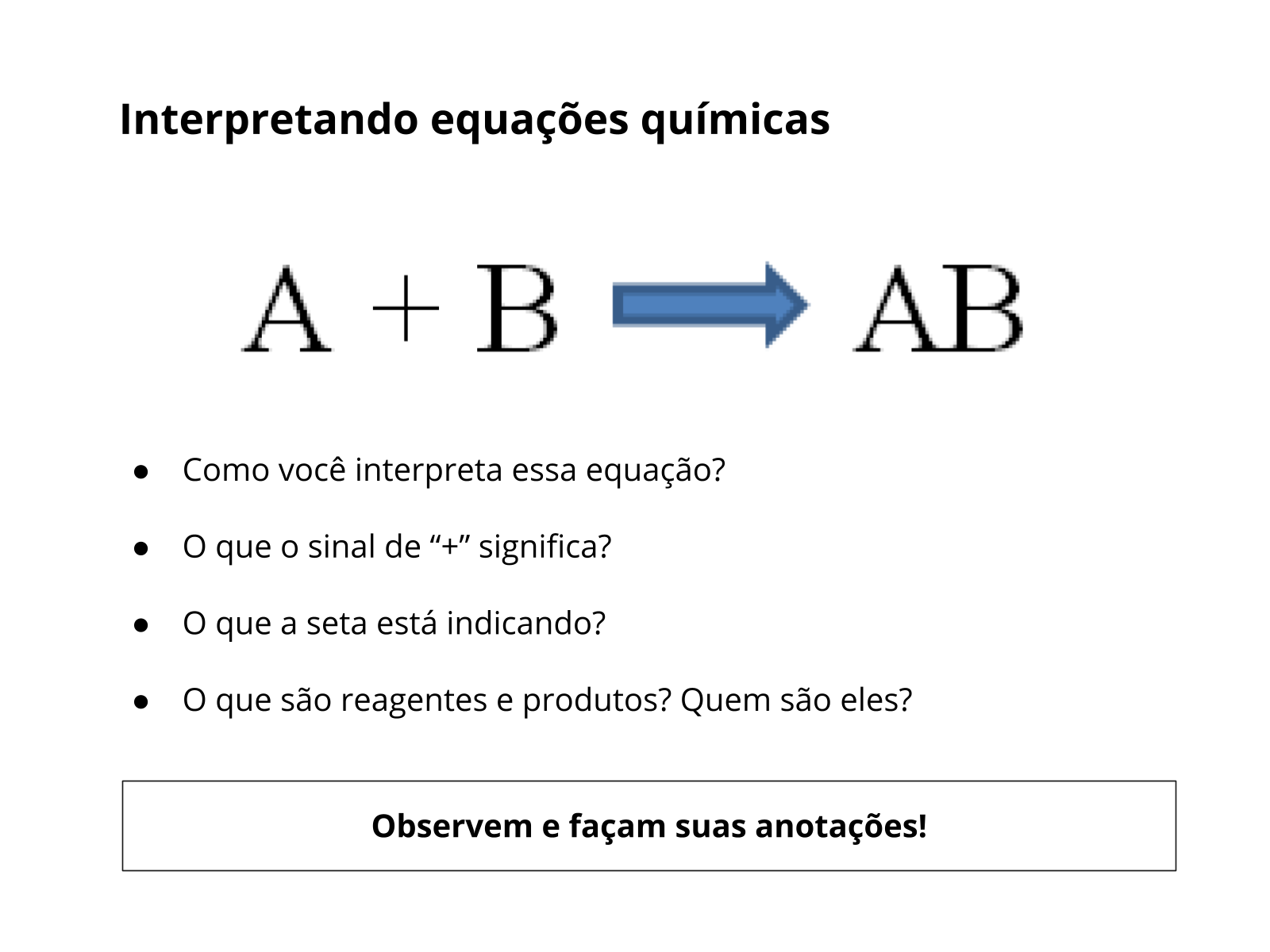
1) A equação pode ser interpretada como: A e B reagem (combinam-se) para formar o composto AB.
2) O sinal de “+” significa que o reagente B foi adicionado ao reagente A, ou vice versa.
3) A seta está indicando o caminho da reação, partindo de A e B para produzir o composto AB: átomos e/ou moléculas de A e B estão se rearranjando e interagindo entre si (combinando-se) para formar o produto AB.
4) A palavra “reagentes”, como o próprio nome sugere, indica os componentes que irão reagir entre si, para formar os produtos (aquilo que é produzido). Nesse exemplo, os reagentes são identificados como os componentes A e B, enquanto que o produto é o composto AB.
Materiais necessários para a aula: 12 bolas de isopor de 15 mm (por grupo), 1 bola de isopor de 25 mm (por grupo), 6 bolas de isopor de 35 mm (por grupo) 8 bolas de isopor de 50 mm (por grupo), palitos de churrasco, fita adesiva ou cola quente, tinta nas cores vermelho, azul, laranja e verde pincel.
MÃO NA MASSA

Orientações: Faça a impressão das atividades a serem desenvolvidas pelos alunos, disponíveis nos links a seguir:
Atividade para impressão 1 - <https://nova-escola-producao.s3.amazonaws.com/W2Ur5MxSuPs8ZZcxPSQKxcaKVYuKVvY2R5qQzSVauvekrAcTN3pE5hYwkee9/atividade-para-impressao-construindo-modelos-cie9-02me04.pdf>.
Atividade para impressão 2 - <https://nova-escola-producao.s3.amazonaws.com/ZPVcn82TjqEuPnGzrQbahNE4d69HvnQCmjU3JWnPaSn5SyahTy47Awqx7DX5/atividade-para-impressao-equacoes-cie9-02me04.pdf>.
Entregue os modelos de bolas de isopor das moléculas reagentes para os alunos, para que eles possam trabalhar com elas e responder todas as atividades.
Permita o debate e a construção de hipóteses e ideias a respeito das atividades para impressão. Instigue os alunos a montarem as moléculas dos produtos de cada equação a partir dos modelos entregue por você. Faça perguntas de modo a levá-los a perceber que nas reações químicas não podem sobrar ou faltar átomos.
O gabarito das atividades, para ajudá-lo, podem ser acessados através dos links:
Gabarito da atividade 1 - <https://nova-escola-producao.s3.amazonaws.com/kxzuS8gwMyzZSwBG293bQsK2G7SHmpvj4gzxQvajATqCjud9CQbv2HPsYM3y/resolucao-da-atividade-construindo-modelos-cie9-02me04.pdf>.
Gabarito da atividade 2 - <https://nova-escola-producao.s3.amazonaws.com/VGUd2nGnNGq6bmgxVGcqeNanRhDSJu2AErdbGr8aGp945Y9BAKM52CS8qEA9/resolucao-da-atividade-equacoes-cie9-02me04.pdf>.
Se houver possibilidade de usar computadores, apresente um jogo simulando o balanceamento de equações químicas. O jogo apresenta três níveis de dificuldade, modelos de moléculas em 3D e também diversas equações para balanceamento. O simulador pode ser acessado através do link <https://phet.colorado.edu/pt_BR/simulation/balancing-chemical-equations>.
SISTEMATIZAÇÃO
Tempo sugerido: 11 minutos
Orientações: Projete o slide ou escreva as informações no quadro para o desenvolvimento da sistematização.
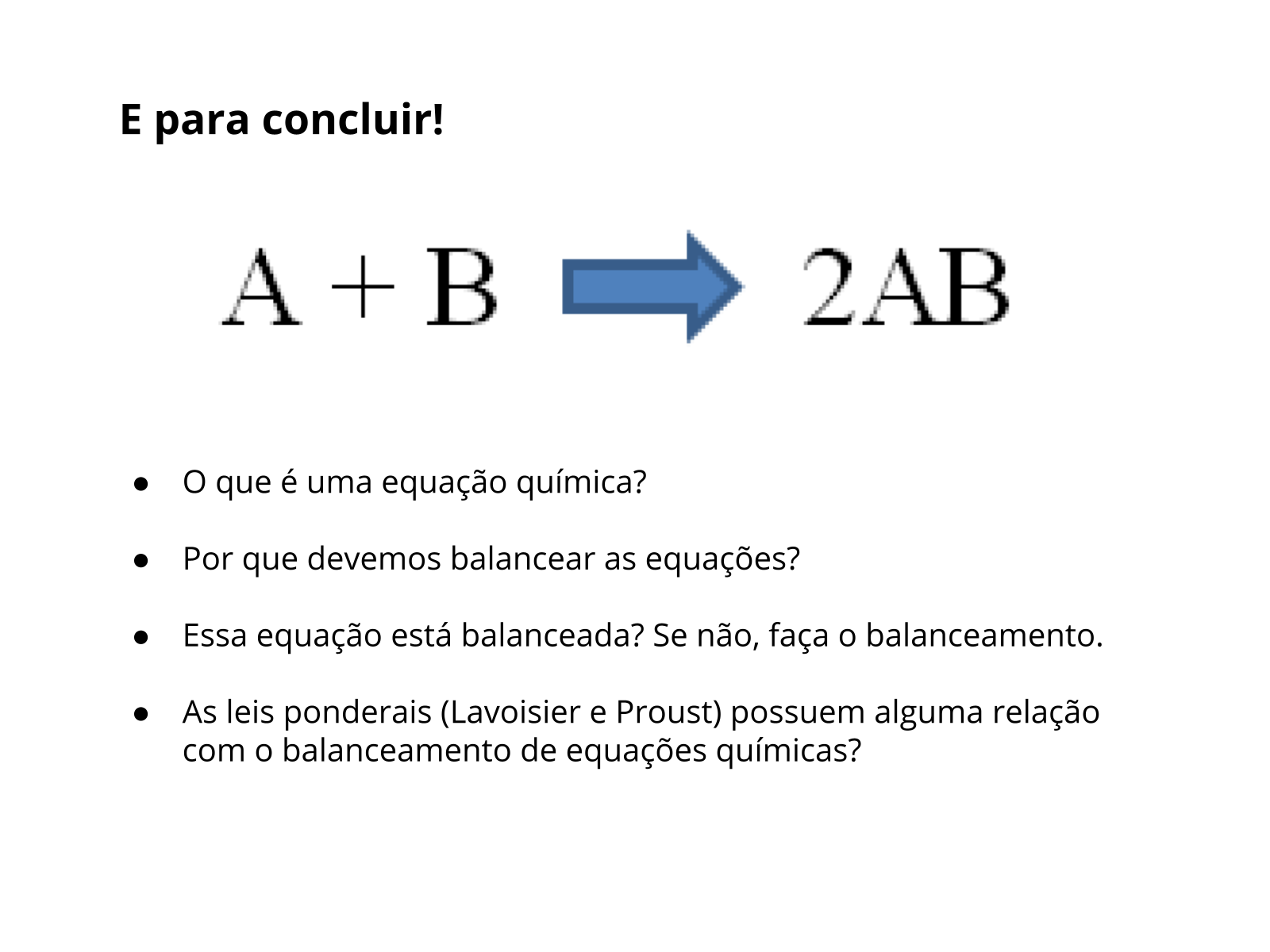
Peça aos grupos que façam um breve debate em conjunto, a fim de construírem suas conclusões sobre o tema desta aula, de modo que eles percebam que a resposta para a questão disparadora é “balancear a equação, acertando os coeficientes estequiométricos”. Desta forma, os alunos devem chegar até as seguintes conclusões:
1) Equações químicas são representações gráficas de reações químicas. Uma equação apresenta de forma teórica, e direta, a relação entre reagentes e produtos. A equação química não é a reação, apenas a sua representação, é a linguagem que os químicos usam para contar “a história” do que acontece na transformação em questão.
2) Equações químicas devem ser balanceadas para estabelecer uma relação de proporção entre reagentes e produtos, pois a quantidade de átomos presente nos reagentes deve ser a mesma quantidade nos produtos, uma vez que reações químicas são “rearranjos de átomos”! Em uma transformação química não há criação nem destruição de átomos. Ligações químicas nos reagentes são rompidas e novas são formadas para se chegar ao produto.
3) A equação balanceada é representada por 2A + 2B ---> 2AB, a quantidade de átomos nos reagentes é igual a quantidade de átomos nos produtos.
4) Lei de Lavoisier (conservação das massas): Afirma que a massa de reagentes e produtos devem ser as mesmas, em um sistema fechado - segundo a célebre frase creditada a Lavoisier, “na natureza nada se cria, nada se perde, tudo se transforma”. Transportando essa lei também para a escala atômica (submicroscópica), em uma reação química a quantidade de átomos de reagentes e produtos devem ser a mesmas, ou seja, átomos não podem ser criados ou perdidos durante uma reação química. Por esse motivo realiza-se o balanceamento de equações químicas, estabelecendo o equilíbrio e a proporção entre reagentes e produtos.
Lei de Proust (proporções constantes): Afirma que para ocorrer uma reação química deve-se estabelecer uma relação proporcional entre reagentes e produtos. O professor pode fazer a analogia, novamente, com a gastronomia.
Sugestão de adaptação para ensino remoto
Ferramentas sugeridas
Essenciais:
- Videochamadas: Zoom ou Hangouts.
- Envio de mensagens e documentos: e-mail, Whatsapp ou Google Classroom.
Optativas: caso a turma disponha de tempo e de conexão síncrona de qualidade, os alunos podem construir a cadeia virtualmente, com o professor compartilhando as imagens em arquivos do Google Drive.
Contexto e questão disparadora
Peça para os estudantes lerem o texto presente nos slides "Contexto". Proponha que anotem o que entenderam sobre a equação. Peça para eles refletirem sobre a questão disparadora:
- O que fazer para que não sobre ou falte nenhum átomo ao escrever uma equação química?
Mão na massa
Divida a turma em cinco grupos. Envie a atividade abaixo e as atividades em Word que estão nos links.
Interpretando equações químicas:

- Como você interpreta essa equação?
- O que o sinal de “+” significa?
- O que a seta está indicando?
- O que são reagentes e produtos? Quem são eles?
Link 1 (disponível aqui).
Link 2 (disponível aqui).
Explique que eles podem trabalhar individualmente e, depois, se reunir com o grupo pelo Zoom ou pelo próprio Whatsapp.
Marque a data com os representantes dos grupos e peça para eles enviarem a atividade.
Material de apoio: (disponível aqui).
Sistematização
Marque uma videochamada com toda a turma pelo Google Meet. Proponha uma conversa sobre “balancear a equação, acertando os coeficientes estequiométricos”.
Tutorial Google Meet (disponível aqui).
Convite às famílias
Os membros da família podem colaborar estimulando a execução das atividades.
Balanceamento de Equações Químicas
9º ano
Objetivos de aprendizagem
Interpretar equações químicas e resolver o seu balanceamento estequiométrico.
Habilidade da Base Nacional Comum Curricular
(EFO9CI02) Comparar quantidades de reagentes e de produtos envolvidos em transformações químicas, estabelecendo a proporção entre suas massas.
Professor-autor: João Paulo Trindade dos Santos
Mentor: Denise Curi
Especialista: Leandro Holanda
Sobre esta aula: Para o pleno desenvolvimento desse plano, é essencial que os alunos tenham construído e desenvolvido habilidades
referente aos três planos, anteriores, desta unidade, sobre reações de combustão, lei da conservação das massas (Lavoisier) e lei das proporções constantes (Proust).
Este plano tem por objetivo possibilitar que os alunos observem e resolvam o balanceamento de equações químicas através da utilização de modelos de bolas de isopor (representando moléculas) e da análise de dados. Para isso, eles receberão duas atividades que serão desenvolvidas no mão na massa. As atividades a serem impressas estão disponíveis nos links a seguir:
Atividade para impressão 1 - <https://nova-escola-producao.s3.amazonaws.com/W2Ur5MxSuPs8ZZcxPSQKxcaKVYuKVvY2R5qQzSVauvekrAcTN3pE5hYwkee9/atividade-para-impressao-construindo-modelos-cie9-02me04.pdf>.
Atividade para impressão 2 - <https://nova-escola-producao.s3.amazonaws.com/ZPVcn82TjqEuPnGzrQbahNE4d69HvnQCmjU3JWnPaSn5SyahTy47Awqx7DX5/atividade-para-impressao-equacoes-cie9-02me04.pdf>.
O gabarito das atividades podem, também, ser acessados nos links a seguir:
Gabarito da atividade 1 - <https://nova-escola-producao.s3.amazonaws.com/kxzuS8gwMyzZSwBG293bQsK2G7SHmpvj4gzxQvajATqCjud9CQbv2HPsYM3y/resolucao-da-atividade-construindo-modelos-cie9-02me04.pdf>.
Gabarito da atividade 2 - <https://nova-escola-producao.s3.amazonaws.com/VGUd2nGnNGq6bmgxVGcqeNanRhDSJu2AErdbGr8aGp945Y9BAKM52CS8qEA9/resolucao-da-atividade-equacoes-cie9-02me04.pdf>.
O professor deverá providenciar os modelos de bolas das moléculas dos reagentes de acordo com as instruções disponíveis neste link: <https://nova-escola-producao.s3.amazonaws.com/TumB3UNnSqVsUEz5ttyneETYy5qvvWT7bqwN7krD4JREZMa56cP7uazrfXRa/instrucoes-para-o-professor-mao-na-massa-cie9-02me04.pdf>.
Além disso, se houver possibilidade de usar computadores, o professor pode apresentar um jogo simulando o balanceamento de equações químicas. O jogo apresenta três níveis de dificuldade, modelos de moléculas em 3D e também diversas equações para balanceamento. O simulador pode ser acessado através do link <https://phet.colorado.edu/pt_BR/simulation/balancing-chemical-equations>. Acesse o link, inicie com a Introdução e escolha em ferramentas a balança, que facilita a visualização do balanceamento das equações. Depois você pode propor um desafio escolhendo Jogo. O simulador é autoexplicativo e muito simples de usar.
Materiais necessários para a aula: 12 bolas de isopor de 15 mm (por grupo), 1 bola de isopor de 25 mm (por grupo), 6 bolas de isopor de 35 mm (por grupo) 8 bolas de isopor de 50 mm (por grupo), palitos de churrasco, fita adesiva ou cola quente, tinta nas cores vermelho, azul, laranja e verde pincel.