Atividade para impressão com bolinhas de isopor - Átomos & Moléculas
Plano de Aula
Plano de aula: Átomos & Moléculas
Plano 5 de uma sequência de 5 planos. Veja todos os planos sobre Estrutura da matéria
Tem interesse no tema "Neurociência, adolescências e engajamento nos Anos Finais"?
Inscreva-se neste tema para receber novidades pelo site e por email.
Habilidades BNCC:
Planeje suas aulas pelo Whatsapp!
Qualidade com economia de tempo
Aula
Sobre este plano

Este slide não deve ser apresentado para os alunos, ele apenas resume o conteúdo da aula para que você, professor, possa se planejar.
Sobre esta aula: nesta aula, serão abordados aspectos que fazem parte do trabalho com uma das habilidades de Ciências relacionados a Matéria e Energia. Você observará que a habilidade não será contemplada em sua totalidade e que as propostas podem ter continuidade em aulas subsequentes.
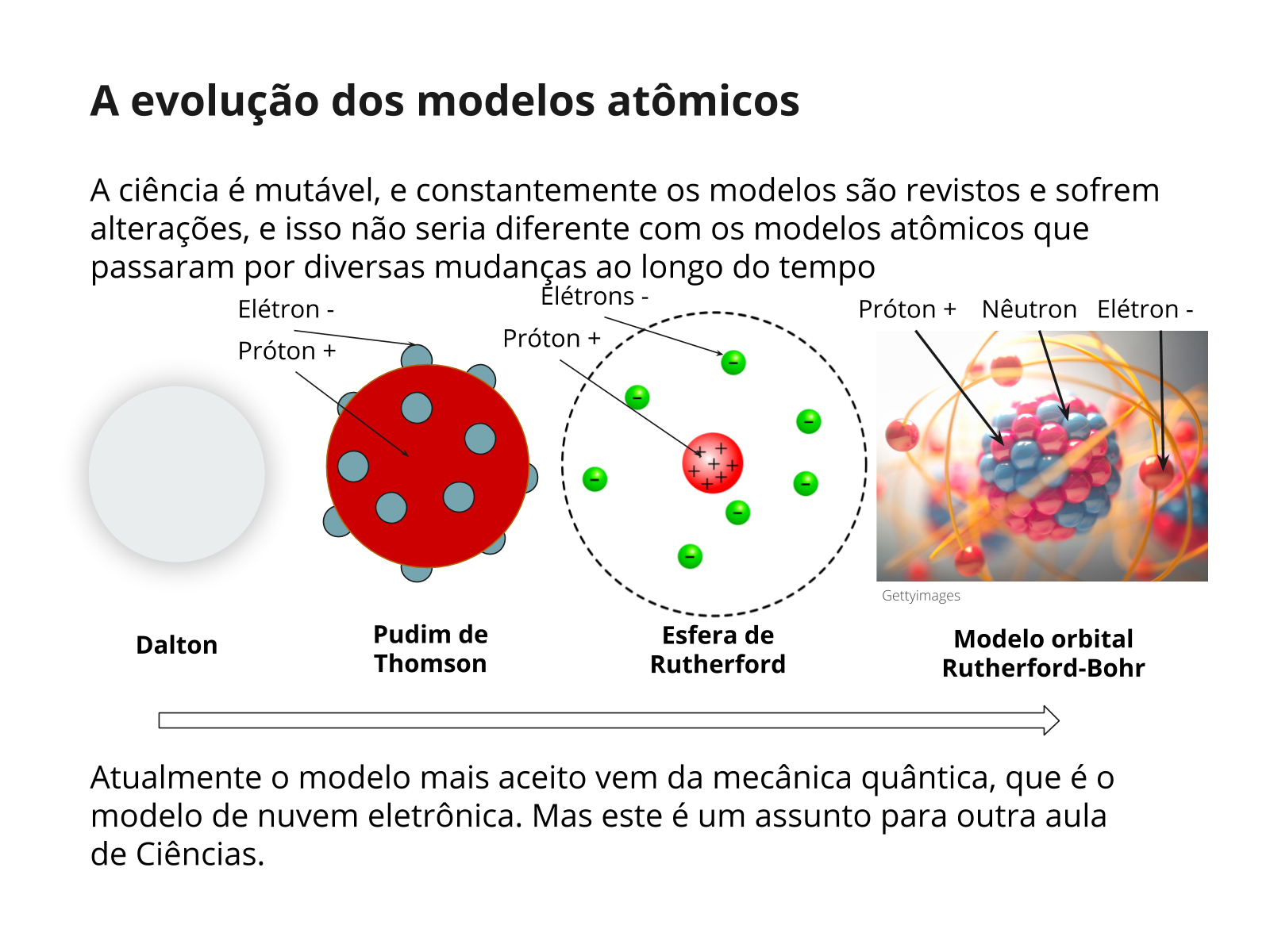
Esta pode ser considerada uma aula que dá continuidade sobre a temática e uma atividade diagnóstica para identificar as concepções dos alunos sobre o tema. Entretanto, é recomendado que o aluno tenha noções básicas de modelos atômicos, estrutura dos átomos e tabela periódica, tema dos planos CIE9_03ME02, CIE9_03ME03 e CIE9_03ME04.
Serão abordados assuntos relacionados ao modelo atômico de Rutherford-Bohr e à tabela periódica. Será proposto que o aluno desenvolva uma ilustração que faça alusão ao modelo atômico para relacionar com diferentes tipos de elementos químicos de uma tabela periódica. É importante que o aluno já possua competências para analisar um modelo científico, assunto que foi tratado no plano CIE09_03ME01.
ATENÇÃO: Esta aula utiliza o simulador “Monte um molécula” (em inglês “build a molecule”), disponível em: <https://phet.colorado.edu/pt/simulation/build-a-molecule> e, por isso, requer computador com o software JAVA instalado.
Caso não seja possível utilizar a simulação, você encontra uma opção para realizar a aula empregando bolinhas de isopor, cujo procedimento você encontra no material complementar.
Escolha a alternativa mais adequada à realidade de sua escola.
Para se preparar, veja as referências abaixo:
Sobre substâncias, moléculas e ligações químicas:
FONSECA, B. T. , Substância Química, InfoEscola , disponível em <https://www.infoescola.com/quimica/substancia-quimica/ > Acesso em: 5 Ago. 2018.
LIRA, J. C. L, Molécula, InfoEscola , disponível em <https://www.infoescola.com/quimica/molecula/ > Acesso em: 5 Ago. 2018.
Da SILVA, A.L.S., Ligação Química, InfoEscola, dsiponível em <https://www.infoescola.com/quimica/ligacoes-quimicas/> Acesso em: 5 Ago. 2018.
Sobre o pesquisador Dmitri Ivanovic Mendeleev e a tabela periódica:
de SOUZA, L. A. Mundo Educação, Cientistas Famosos disponível em <https://mundoeducacao.bol.uol.com.br/quimica/dmitri-mendeleev.htm> Acesso em: 20 jul. 2018.
DAYAH, M. Tabela Periódica Dinâmica, disponível em <https://www.ptable.com/?lang=pt> Acesso em: 20 jul. 2018.
Software de simulação atômica:
Lancaster K, et al, Monte um atomo, University of Colorado Boulde, disponível em <https://phet.colorado.edu/pt/simulation/build-a-molecule> Acesso em 20 de jul. 2018.
OBS: o simulador precisa do JAVA instalado para rodar <https://www.java.com/pt_BR/> Acesso em 20 de jul. 2018.
Materiais necessários para a aula: computador, projetor, anteparo, software de simulação atômica, material impresso.Link para o material a ser impresso:
Atividade com computador (material complementar)
Atividade com bolinhas de isopor (material complementar)
OBS: para o mão na massa do material alternativo os materiais necessários são diferentes e se encontram listados no respectivo roteiro: (material complementar).
Título da aula

Tempo sugerido: 2 minutos
Orientações: Organize os alunos em semicírculo. Leia o tema da aula e comente que eles serão os cientistas responsáveis pela investigação de como são formadas todas as substâncias químicas que conhecemos no dia a dia.
Atenção: esta aula pode ter dois mãos na massas possíveis, tudo depende da disponibilidade de computadores para os alunos. Também é possível usar um computador com um retroprojetor em sala. Caso não tenha essa disponibilidade, pode optar pelo mão na massa alternativo, uma atividade com bolinhas de isopor.
Link para o mão na massa alternativo com bolinhas de isopor (material complementar).
Novo curso gratuito

Conheça nosso mais novo curso sobre adolescências, neurociência e engajamento nos anos finais
VER CURSO