Atividade para impressão com cartolina
Plano de Aula
Plano de aula: Número atômico Z e a tabela periódica
Plano 4 de uma sequência de 5 planos. Veja todos os planos sobre Estrutura da matéria
Por: Ellen Bernardi
Sobre este plano

Este slide não deve ser apresentado para os alunos, ele apenas resume o conteúdo da aula para que você, professor, possa se planejar.
Sobre esta aula: serão abordados aspectos que fazem parte do trabalho com uma das habilidades de Ciências relacionados a Matéria e Energia. Você observará que a habilidade não será contemplada em sua totalidade e que as propostas podem ter continuidade em aulas subsequentes.
Esta pode ser considerada uma aula que dá continuidade a temática e uma atividade diagnóstica para identificar as concepções dos alunos sobre o tema. Entretanto, é recomendado, para esta aula, que o aluno tenha noções básicas de modelos atômicos e estrutura dos átomos, abordados nos planos CIE9_03ME02 e CIE9_03ME03.
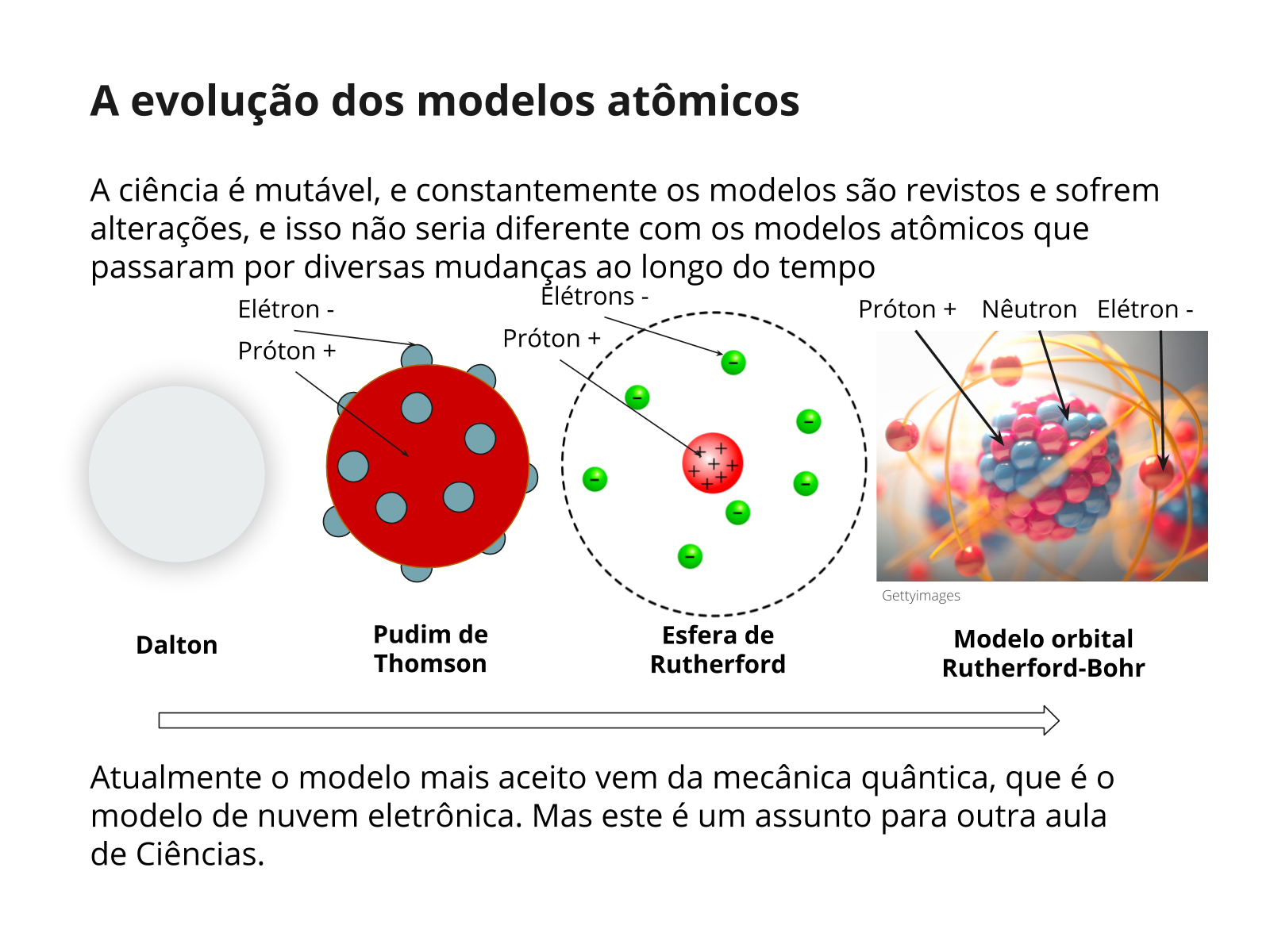
Nesta aula serão abordados assuntos relacionados ao modelo atômico de Rutherford-Bohr e à tabela periódica. Será proposto que o aluno desenvolva uma ilustração que faça alusão ao modelo atômico para relacionar com diferentes tipos de elementos químicos de uma tabela periódica. Para esta aula, é importante que o aluno já possua competências para analisar um modelo científico, assunto que foi tratado no plano CIE09_03ME01.
ATENÇÃO: esta aula utiliza o simulador “Monte um átomo” (em inglês “build an atom”), disponível em: <https://phet.colorado.edu/pt_BR/simulation/legacy/build-an-atom> . Por isso, requer computador com o software JAVA instalado.
Caso não seja possível utilizar a simulação, você encontra uma opção para realizar a aula empregando cartolinas, cujo procedimento pode ser encontrado aqui:
Escolha a alternativa mais adequada à realidade de sua escola.
Para se preparar para esta aula, veja as referências abaixo:
Sobre o modelo atômico de Rutherford-Bohr:
Portal TodaMatéria, disponível em <https://www.todamateria.com.br/modelo-atomico-de-rutherford/> Acesso em: 14 jul. 2018.
Portal TodaMatéria, disponível em <https://www.todamateria.com.br/modelo-atomico-de-bohr/> Acesso em: 14 jul. 2018.
Sobre o pesquisador Dmitri Ivanovic Mendeleev e a tabela periódica:
de SOUZA, L. A. Mundo Educação, Cientistas Famosos disponível em <https://mundoeducacao.bol.uol.com.br/quimica/dmitri-mendeleev.htm> Acesso em: 20 jul. 2018
DAYAH, M. Tabela Periódica Dinâmica, disponível em <https://www.ptable.com/?lang=pt> Acesso em: 20 jul. 2018
Software de simulação atômica:
Lancaster K, et al, Monte um atomo, University of Colorado Boulde, disponível em <https://phet.colorado.edu/pt_BR/simulation/legacy/build-an-atom> Acesso em 20 de jul. 2018.
OBS: o simulador precisa do JAVA instalado para rodar <https://www.java.com/pt_BR/> Acesso em 20 de jul. 2018.
Link para o material a ser impresso:
Atividade com computador
Atividade com cartolina
Tabela periódica
Materiais necessários para a aula: computador, projetor, anteparo, software de simulação atômica, material impresso.
Título da aula

Tempo sugerido: 2 minutos
Orientações: Organize os alunos em semicírculo. Leia o tema da aula e comente que eles serão os cientistas responsáveis pela avaliação, interpretação e relação da tabela periódica com o modelo atômico de Bohr-Rutherford.
Atenção: esta aula pode ter dois mãos na massas possíveis, tudo depende da disponibilidade de computadores para os alunos, que também pode ser um computador com retroprojetor em sala. Caso não tenha essa disponibilidade, é possível optar pelo segundo mão na massa alternativo, uma atividade com cartolinas coloridas.
Link para o mão na massa alternativo com cartolinas
Contexto

Tempo sugerido: 7 minutos
Orientações: pergunte se eles já pararam para pensar que existem diferentes materiais no mundo e que cada um deles é composto por átomos. Lance a questão
- Como se diferencia um átomo de alumínio de um carbono ou hidrogênio?
Devido ao trabalho do químico Dmitri Mendeleev foi possível o desenvolvimento dos estudos das propriedades dos elementos e suas massas atômicas. Pergunte:
- Vocês já mediram a massa de algum objeto na balança?
- Como eles deveriam ser classificados?
A ideia não é manter um diálogo prolongado, apenas estimular e contextualizar a aula. Não se preocupe em responder todas as questões levantadas aqui.
Em seguida, comente sobre a atividade que irão realizar: “hoje vocês serão os pesquisadores atômicos e mostrarão as características de um átomo classificando-os de acordo com suas propriedades.”
Neste contexto, a ideia é trabalhar a capacidade do aluno de relacionar o modelo atômico de Rutherford-Bohr com as informações da tabela periódica de Mendeleev.
Questão disparadora

Tempo sugerido: 3 minutos
Orientações: ainda no semicírculo, diga para os alunos imaginarem que eles são pesquisadores e que serão responsáveis pela análise correlativa entre o modelo atômico de Rutherford-Bohr e a classificação/organização de um elemento químico na tabela periódica. Também irão analisar como a organização das partículas subatômicas estão associadas às características de um elemento químico.
Leia a questão disparadora. Deixe que os alunos compartilhem suas opiniões sobre o tema e levantem hipóteses sobre quais seriam a melhor rota para conduzir a pesquisa. Não corrija as rotas propostas por eles neste momento, especialmente a questão da organização dos elementos químicos segundo suas estruturas. Deixe o senso crítico de cada aluno agir. A atividade proposta os levará à construção desse conhecimento.
A divisão da turma em grupos dependerá da disponibilidade de computadores na escola. Caso não tenha computadores disponíveis, separe os alunos em 6 grupos e instrua-os de acordo com o plano alternativo trabalhando com cartolinas. Link para o mão na massa alternativo com cartolinas:
Mão na massa
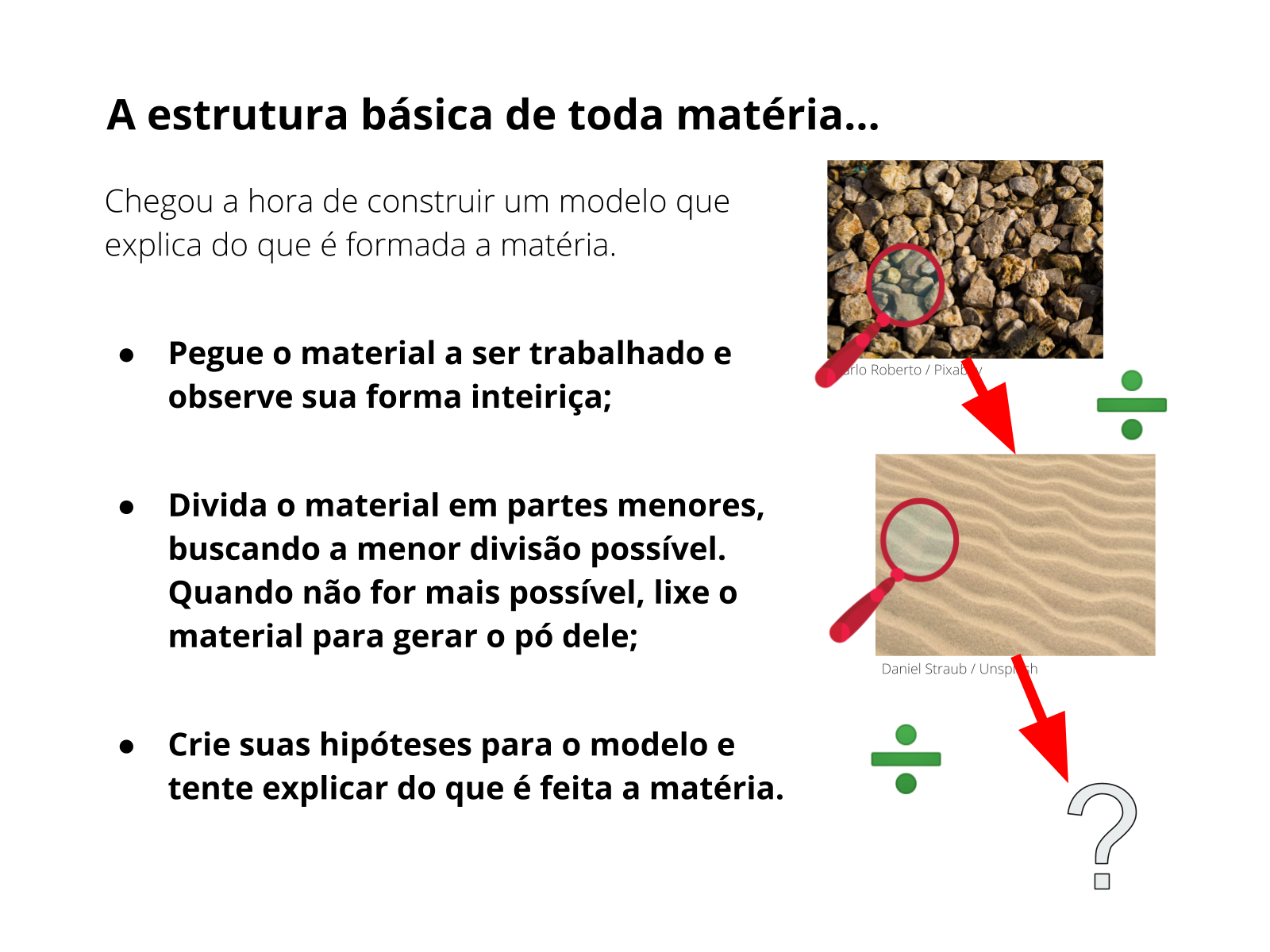
Tempo sugerido: 23 minutos.
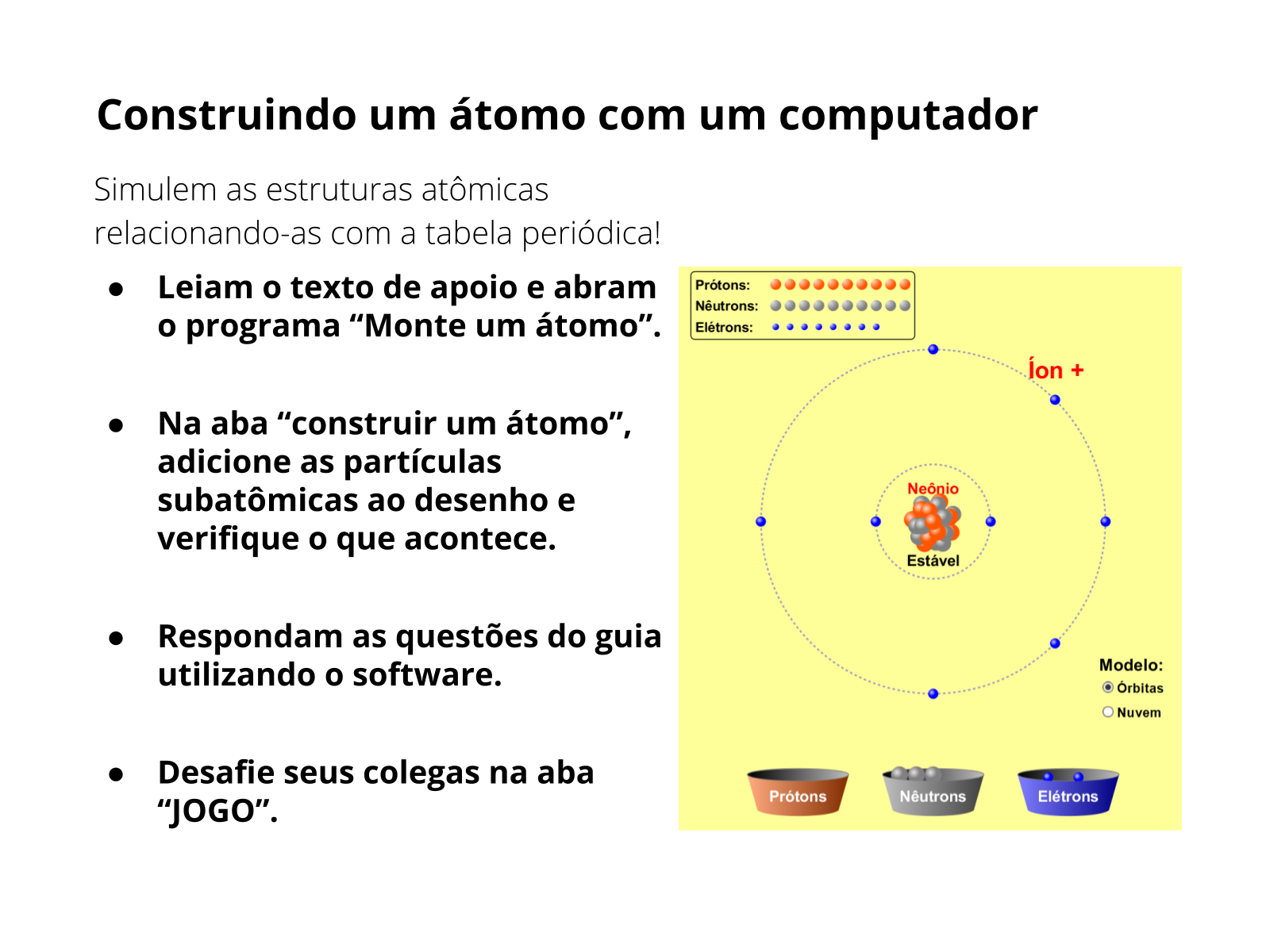
Orientações: caso o professor opte pela aula no computador utilizando o software “Monte um átomo”, deixe tudo preparado antes da atividade. Baixe e instale o programa “JAVA”, em seguida baixe o software “Monte um átomo” (em inglês “build an atom“).
Caso o professor não disponha de um computador para a atividade, utilize o material alternativo complementar, disponível em:
< https://nova-escola-producao.s3.amazonaws.com/78EBSU6fURg27Fr6A2XTtkegdDBxFfPTVjnwQWgC32vj3szZDVrJCyddUR3g/atividade-para-impressao-com-computador-cie9-03me04-1.pdf > e siga as respectivas instruções.
Explique a atividade usando o slide projetado. Distribua o material impresso ou peça que os alunos abram o documento google no computador e oriente-os de acordo com as instruções. Para isso, organize os alunos de acordo com a disponibilidade de computadores, garantindo que eles trabalhem em duplas, mesmo que tenha computador para todo mundo. A discussão de ideias enriquece os argumentos hipotéticos. Auxilie-os nas dúvidas com relação a informática, mas deixe se divertirem com o software. O programa é auto-explicativo, então dificilmente os alunos terão problemas caso tudo esteja instalado adequadamente.
Sugira que se familiarizem com a aba “construir um átomo”, pois é nela que eles trabalharão para responder o questionário.
Dê a eles 10 minutos para discutirem e responderem aos questionários.
Nos 13 minutos finais, peça para clicarem na aba “JOGO”. Nesta aba existem 4 níveis, desafie-os a fazer as atividades e veja quem faz mais pontos no menor tempo. Parabenize a melhor dupla (ou grupo) com uma salva de palmas coletiva!
Acompanhe o trabalho e procure colaborar com os grupos que tiverem dúvidas.
Sobre a teoria de estabilidade nuclear e distribuição eletrônica dos átomos:
- O número atômico de um átomo está relacionado ao número de prótons (Z) que o elemento químico apresenta;
- De maneira geral*, para que o átomo seja nuclearmente estável, o número de prótons deve ser igual ao número de nêutrons. Caso haja diferença entre o número de prótons e elétrons o átomo está num estado instável;
- Os elétrons têm massa muito pequena (9,10938356 × 10-22 microgramas) se comparado com a massa dos prótons (1,6726219 × 10-18 microgramas) e dos nêutrons (1.674927471× 10-18 microgramas). Dado estas observações, para calcular a massa total do átomo podemos desprezar a massa do elétron e considerar apenas as massas dos prótons e nêutrons, que são consideradas iguais a 1. Sendo assim, a massa atômica (A) pode ser calculada através da fórmula A= Z + N, onde A é a massa atômica do elemento, Z é o número de prótons (também conhecido como Número Atômico) e N é o número de nêutrons;
- A camada de valência é a última camada de distribuição de elétrons de um átomo. Caso ela não tenha uma configuração eletrônica completa com 8 elétrons, como os gases nobres, sempre haverá uma instabilidade eletrônica que levará à formação de íons (íons positivos nº prótons > nº elétrons , íons negativos nº prótons < nº elétrons);
- Estabilidade nuclear é diferente de estabilidade eletrônica;
* Elementos acima de 83 prótons, como o urânio (Z = 92), são instáveis.
Materiais necessários para aula: computador, projetor, anteparo, software de simulação atômica, material impresso.
Links para esta aula:
1. Atividade com computador para impressão:
2. Software de simulação e o JAVA
<https://phet.colorado.edu/pt_BR/simulation/legacy/build-an-atom>
3. Tabela Periódica Dinâmica
<https://www.ptable.com/?lang=pt>
Tabela periódica para imprimir, caso ache necessário
Sistematização
Tempo sugerido: 15 minutos.
Orientações: proponha uma roda de conversa para que os alunos possam compartilhar o que aprenderam durante a atividade. Discuta as questões do slide, verifique se houve algum erro conceitual.
Retome a questão disparadora e pergunte para os alunos as questões descritas no slide.
Os alunos devem responder :
- Que um elemento químico é definido pelo seu número de prótons, também conhecido como número atômico Z.
- Sobre a organização da tabela periódica, é importante que o aluno perceba que a tabela é organizada em ordem crescente de números atômicos Z (número de prótons). A organização dos elementos se inicia na esquerda e vai para a direita, aumentando uma unidade no número atômico por elemento químico, ao término da linha a contagem vai para próxima linha e assim por diante.
- Um íon negativo é um átomo que contém mais elétrons do que prótons em sua distribuição de carga. Do mesmo modo, um íon positivo é aquele que perdeu elétrons e, portanto, tem carga elétrica positiva.
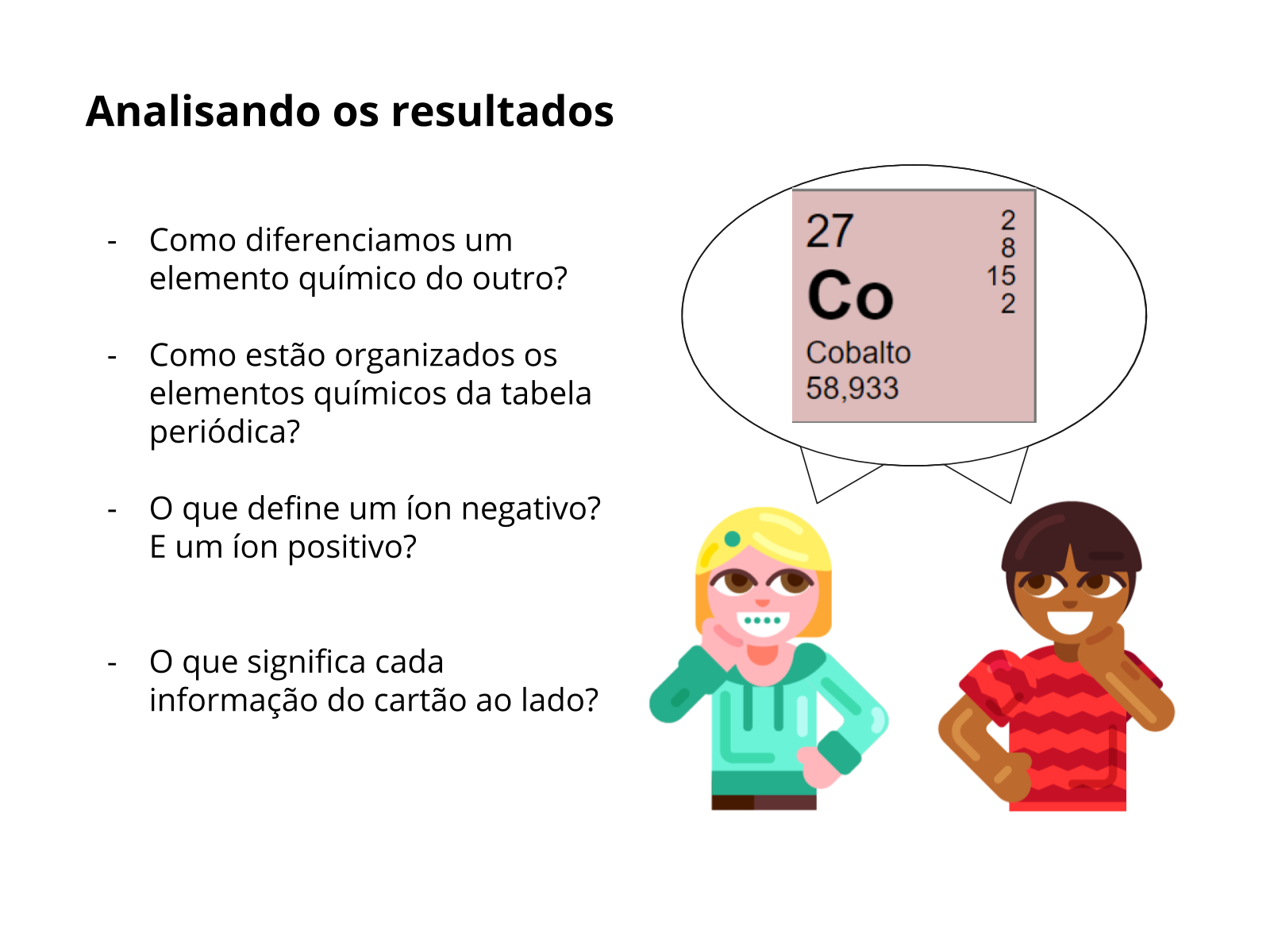
- No cartão do lado, o número 27 representa o número atômico e “Co” é o símbolo do elemento químico cujo seu nome é Cobalto, seu peso atômico é de 58,933 unidades atômicas, os números a direita são como os elétrons estão distribuídos nas camadas eletrônicas segundo o modelo de Bohr-Rutherford. Cada camada tem um número específicos de elétrons que ela pode aceitar, como mostra a simulação.
- Além disso, os alunos devem ser capazes de calcular a massa atômica de qualquer elemento químico através do número de prótons e do número de nêutrons. Ou seja, eles devem saber que a massa atômica é a soma do número de prótons e de nêutrons.
As questões abaixo podem ajudá-lo na condução da sistematização e formalização do aprendizado:
- Alguém elaborou alguma hipótese diferente dos demais?
Esse debate é importante para que os alunos indiquem as hipóteses que foram escolhidas, percebam a importância da observação no ensino de Ciências e como isso pode gerar novas ideias e propostas de novas teorias para explicar determinados eventos. É possível que surjam questões como:
- Como quebramos um átomo?
- Como observamos isso?
Estas reflexões são importantes para a desenvoltura crítica do aluno.
Sobre o processo de “quebra atômica”:
- Podemos fundir átomos: fusão atômica (como a fusão de dois átomos de hidrogênio no Sol produzindo um átomo de Hélio)
- Podemos particionar átomos: fissão nuclear (como a bomba atômica onde o átomo de Urânio fissiona em dois átomos menores => Bário e Kriptônio, além de três nêutrons que irão fissionar mais átomos de urânio disparando a reação em cadeia).
Sistematização

Tempo sugerido:
Orientações: projete o slide ou leia as informações para sistematizar os aprendizados da aula. Retome o conceito do número atômico Z + tabela periódica e discuta a evolução das descobertas atômicas.
Comente um pouco da história da tabela periódica. Diga que, quando Mendeleev montou a tabela, ele não conhecia todos os elementos químicos que conhecemos hoje em dia. Que ela foi montada colocando os átomos conhecidos em ordem crescente de peso atômico, de modo que os átomos com propriedades químicas semelhantes ficassem agrupados em colunas verticais. Ele deixava espaços vazios, prevendo a descoberta de propriedades dos átomos que viriam a ser encontrados. Ajude os alunos a perceberem que as colunas mostram os átomos que apresentam o mesmo número de elétrons na última camada (na camada de valência), com exceção do He, que apresenta 2 elétrons e todos os outros 8 elétrons na camada de valência. O modelo de Rutherfod-Bohr ainda não havia sido proposto, mas Mendeleev acertou ao agrupar átomos com propriedades semelhantes em colunas pois hoje sabemos que a reatividade química está relacionada ao número de elétrons e sua distribuição eletrônica no átomo. Já as linhas da tabela mostram átomos com o mesmo número de camadas na distribuição eletrônica, Essa periodicidade encontrada na tabela permite prever e entender várias propriedades dos átomos, tornando a tabela periódica uma ferramenta de grande importância para a Ciência.
Essa aula é uma continuidade do estudo da estrutura atômica. Para um melhor desempenho é importante que o aluno tenha noções de metodologia científica e domine o conceito de matéria e átomo.
Para o professor
Sugestão de adaptação para ensino remoto
Ferramentas sugeridas
Essenciais:
- Videochamadas: Zoom ou Hangouts.
- Envio de mensagens e documentos: e-mail, Whatsapp ou Google Classroom.
- Livro didático.
Optativas: caso a turma disponha de tempo e conexão síncrona de qualidade, os alunos podem construir a cadeia virtualmente, com o professor compartilhando as imagens em arquivos do Google Drive.
Contexto e questão disparadora
Peça para os estudantes lerem o texto presente nos slides "Contexto". Proponha uma conversa apenas para estimular e contextualizar a aula. Não se preocupe em responder todas as questões levantadas aqui. Peça para eles refletirem sobre a questão disparadora:
- Como os átomos se diferenciam uns dos outros?
Mão na massa
A atividade será realizada individualmente.
Peça para os estudantes utilizarem a tabela periódica do livro didático para responder as questões abaixo:
1- Quais são os cinco grandes grupos da tabela periódica?
2- Cite as principais características:
a) Dos metais:
b) Dos ametais:
c) Dos semimetais:
d) Do hidrogênio:
3- Relacione os seis gases nobres e suas principais características
4- Consultando a tabela, complete o quadro:
| Símbolo | z | Nome do elemento | Nº de camadas de elétrons | nº de elétrons na última camada |
| Li | ||||
| Mg | ||||
| Cs | ||||
| C | ||||
| O |
5- Quais são os tipos de partículas que formam o núcleo atômico?
Caso os estudantes tenham acesso a internet, oriente que acessem o link: “Tabela Periódica Dinâmica” (disponível aqui).
Marque uma data, para que eles enviem a atividade via e-mail ou Whatsapp.
Sistematização
Marque uma videochamada com toda a turma e comente um pouco da história da tabela periódica.
Utilize o slide e retome os questionamentos.
Convite às famílias
Os membros da família podem colaborar na análise dos vídeos ajudando os estudantes a encontrarem padrões de comparação.
Número atômico Z e a tabela periódica
9º Ano
Objetivos de aprendizagem
Relacionar os diferentes elementos químicos com seu respectivo número de prótons (número atômico) e calcular a massa atômica a partir destas informações. Ilustrar como foi construída a tabela periódica através destes conceitos.
Habilidade da Base Nacional Comum Curricular
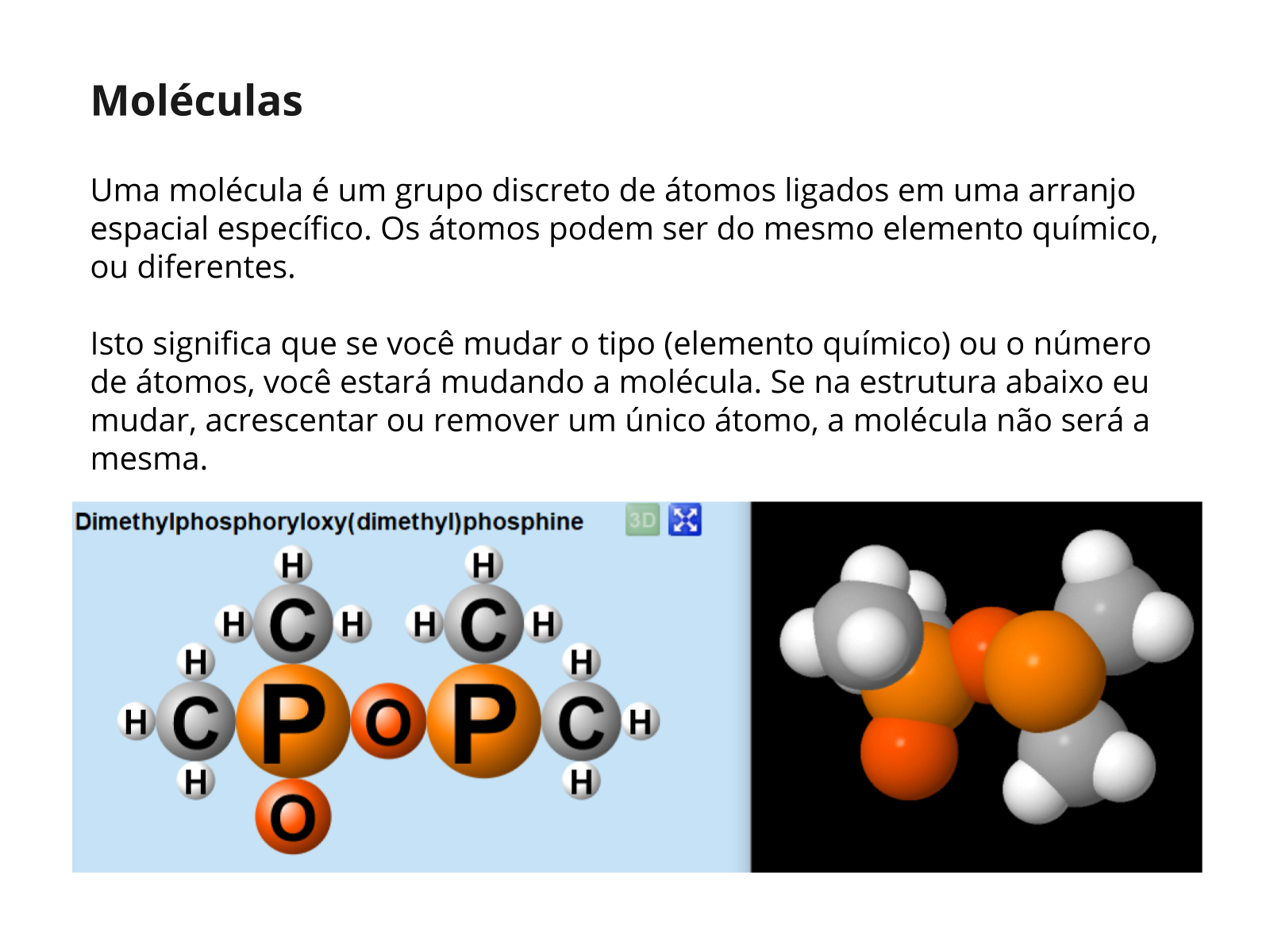
(EF09CI03) Identificar modelos que descrevem a estrutura da matéria (constituição do átomo e composição de moléculas simples) e reconhecer sua evolução histórica.
Professor-autor: Willian Takemitsu Shigeyosi
Mentor: Denise Curi
Especialista: Leandro Holanda
Sobre esta aula: serão abordados aspectos que fazem parte do trabalho com uma das habilidades de Ciências relacionados a Matéria e Energia. Você observará que a habilidade não será contemplada em sua totalidade e que as propostas podem ter continuidade em aulas subsequentes.
Esta pode ser considerada uma aula que dá continuidade a temática e uma atividade diagnóstica para identificar as concepções dos alunos sobre o tema. Entretanto, é recomendado, para esta aula, que o aluno tenha noções básicas de modelos atômicos e estrutura dos átomos, abordados nos planos CIE9_03ME02 e CIE9_03ME03.
Nesta aula serão abordados assuntos relacionados ao modelo atômico de Rutherford-Bohr e à tabela periódica. Será proposto que o aluno desenvolva uma ilustração que faça alusão ao modelo atômico para relacionar com diferentes tipos de elementos químicos de uma tabela periódica. Para esta aula, é importante que o aluno já possua competências para analisar um modelo científico, assunto que foi tratado no plano CIE09_03ME01.